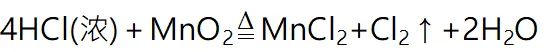在化学实验中,气体的制备是一项重要的研究内容。而氯气作为一种常见的气体,其实验室制备过程也备受关注。侯哥化学对这类知识点做了详细的归纳总结,我们一起来看看!
1制备原理

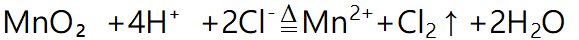
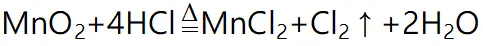
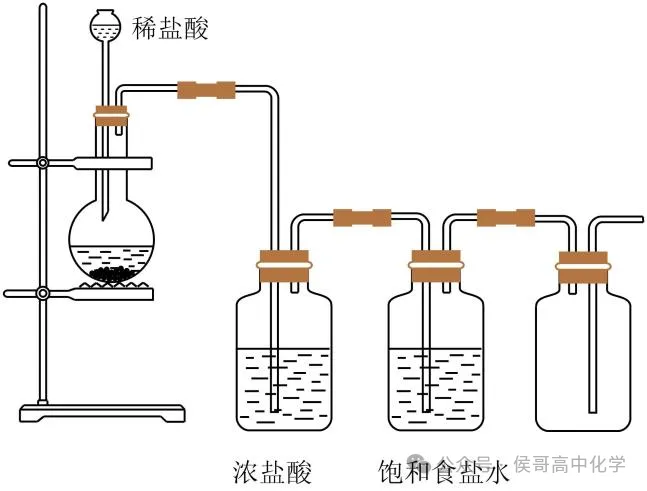
2实验装置

(2)净化装置(除杂装置):由于浓盐酸易挥发,氯气中的杂质气体有HCl、水蒸气,因此无法收集到纯净干燥的氯气。且HCl极易溶于水,而氯气在饱和食盐水中溶解度很小,所以先用饱和食盐水除去Cl₂中的HCl气体,再用浓硫酸进行干燥,除去Cl₂中的水蒸气,就可获得纯净干燥的氯气。
(3)收集装置:向上排空气法或排饱和食盐水法。氯气密度大于空气,能溶于水,与水反应,有毒。所以不能用排水法收集,通常用向上排空气法收集;另外饱和食盐水中Cl⁻浓度较大,抑制了Cl₂与水的反应,Cl₂在饱和食盐水中的溶解度很小,因此可用排饱和食盐水法收集氯气,且用此法可除去实验过程中挥发产生的HCl气体。
(4)尾气处理:用 NaOH溶液吸收多余的Cl₂,以防Cl₂污染空气。氯气有毒,需要设计尾气吸收装置,通常在收集装置的后面连接盛有NaOH溶液的吸收装置,并在通风橱中进行实验。化学方程式为:Cl₂+2NaOH=NaCl+NaClO+H₂O。
(5)判断氯气集满方法(1)氯气是一种黄绿色气体:观察集气瓶中气体颜色的变化,若集气瓶上部充满黄绿色气体,则证明Cl₂已收集满。(2)氯气具有强氧化性:将湿润的淀粉-碘化钾试纸靠近盛Cl₂的瓶口,观察到试纸立即变蓝,则证明已集满。(3)氯气溶于水具有漂白性:将湿润的蓝色石蕊试纸靠近盛Cl₂的瓶口,观察到试纸先变红后褪色的变化,则证明已集满。
3注意事项
(1)反应物必须用浓盐酸,稀盐酸与MnO₂不反应,且随着反应的进行,浓盐酸变为稀盐酸时,反应停止,故盐酸中的HCl不可能全部参加反应。(2)制取的氯气有毒,且在加热时容易逸出,同时分液漏斗便于控制加入浓盐酸的量,所以应选用分液漏斗,而不用长颈漏斗。(3)为了减少制得的Cl₂中HCl的含量,加热温度不宜过高,以减少HCl的挥发。(4)实验结束后,先使反应停止并排出残留的Cl₂后,再拆卸装置,避免污染空气。(5)尾气处理时,用NaOH溶液吸收Cl₂,不能用澄清石灰水吸收,因为澄清石灰水中含Ca(OH)₂的量少,吸收不完全。例题1.实验室制备氯气的装置如下,以下装置中最多有几处错误( )