2024年诺贝尔生理学或医学奖授予科学家维克托·安布罗斯(Victor Ambros)和加里·鲁夫昆(Gary Ruvkun)。

非生物专业的一看,可能第一反应是:
microRNA是个什么鬼?
今年诺奖看似冷门,其实和你的健康息息相关。
这一次诺贝尔生理学或医学奖,又是「发现第一人+深度研究」组合。
维克托·安布罗斯(Victor Ambros)等人在1993年,发现了第一个miRNA[1]。
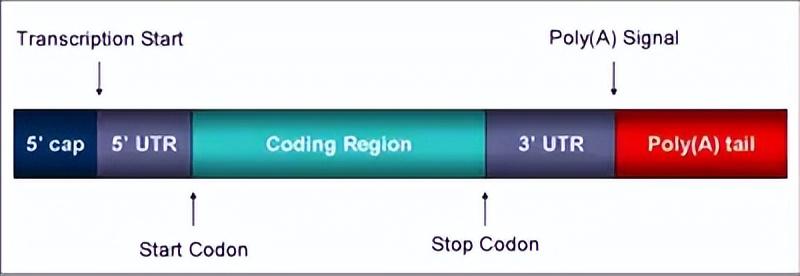
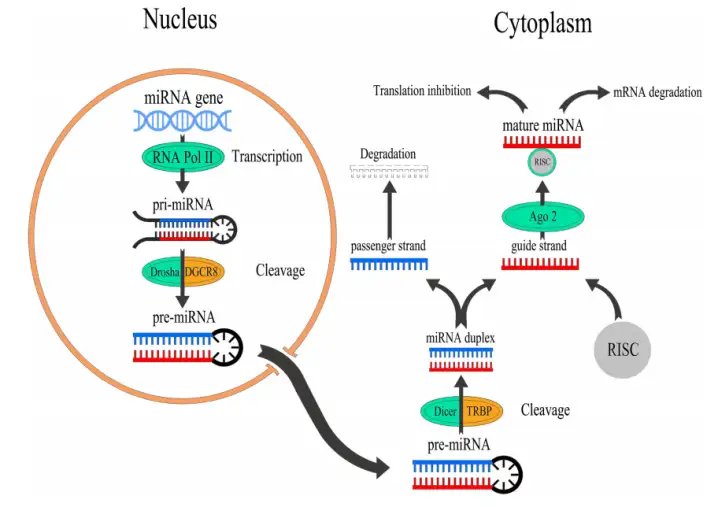
注意,mRNA和miRNA是两个东西,前者是信使RNA,合成蛋白质的模版。后者是微小RNA,属于不参与蛋白质合成的非编码基因,基因编码长度22个左右(通常21~23个核苷酸)。
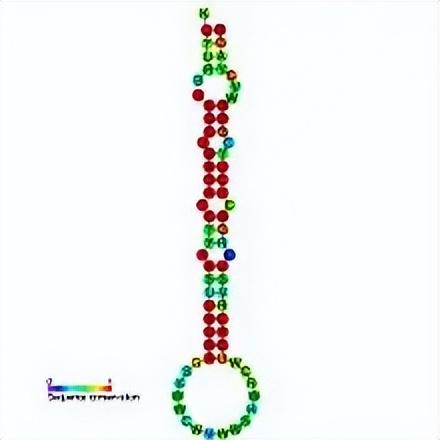
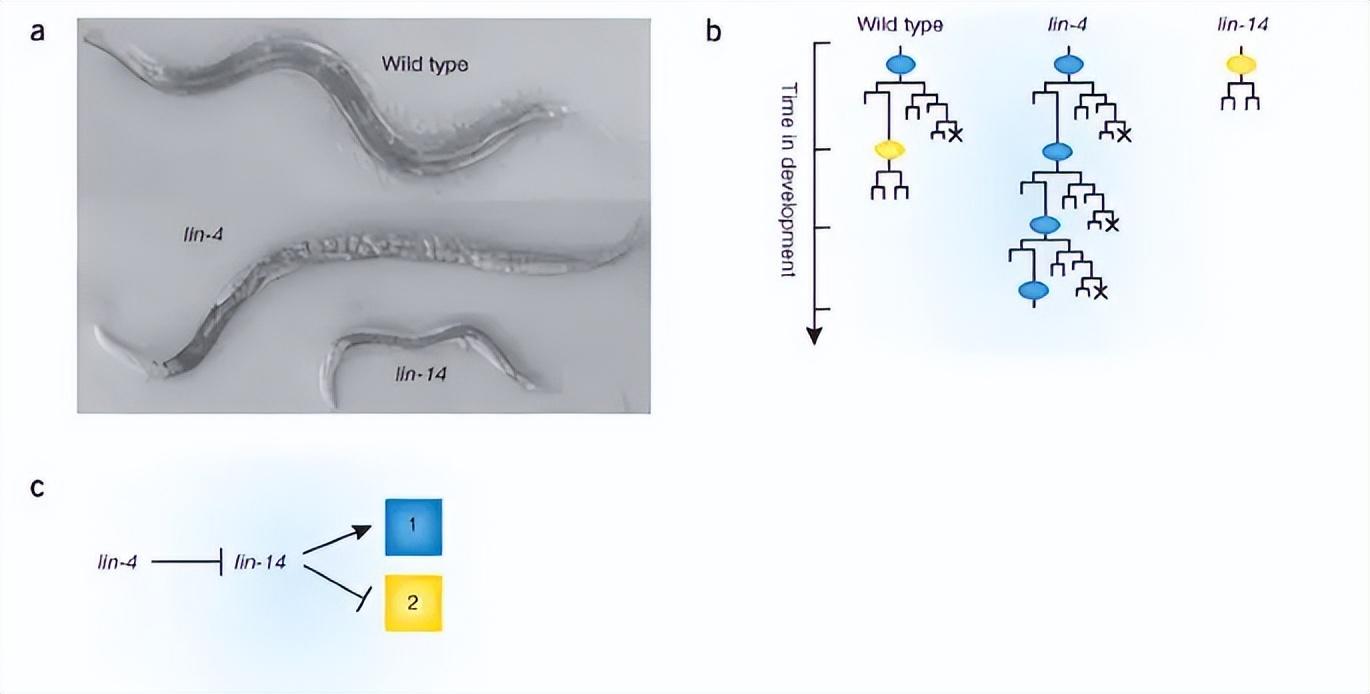
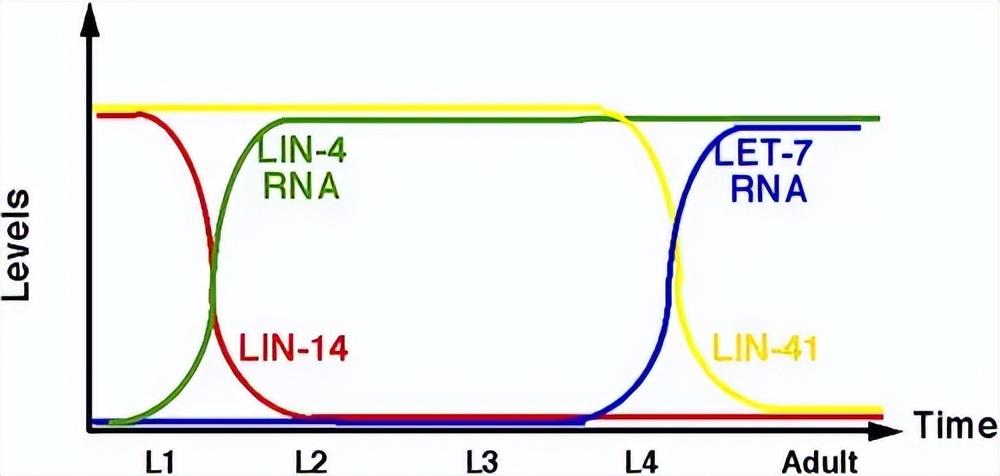
第一个被发现的miRNA是线虫体内的lin-4。
秀丽隐杆线虫作为一种最为简单又“复杂”的模式生物,对于人类分子生物学的研究贡献,真可谓是功不可没[2]。

加里·鲁夫昆(Gary Ruvkun)等人则是同年同实验室,发现了lin-4的作用机制[3]:
通过不完全的碱基配(靶向3’ UTR,也即3'端非编码区域,靠近编码区的尾部),来调控靶基因(LIN-14基因)的翻译表达,从而影响蛋白质合成,最终影响线虫的生长发育。

安布罗斯和鲁夫昆当年共同所处的实验室为麻省理工学院-霍维茨实验室。
正是在2002年,与悉尼·布伦纳、约翰·E·苏尔斯顿等人,共享诺贝尔生理学或医学奖的罗伯特·霍维茨(H. Robert Horvitz)所拥有的实验室。

霍维茨正是以研究秀丽隐杆线虫而著名,因发现细胞程序化凋亡的遗传调控机制而获得诺奖。
可以说,安布罗斯和鲁夫昆获得诺奖,与霍维茨实验室也有着莫大的渊源[4]。
你可能会想,miRNA不就是在秀丽隐杆线虫这样的小虫子里发现的吗?
真的有资格得诺奖吗?
发现这个有啥用呢?
其实一开始,鲁夫昆也真的以为自己的发现,并没有什么大用。
20世纪末期,正是分子生物学大发现的爆发期。然而从1993年鲁夫昆破译其机制以来,后来的多年时间,他在miRNA领域,都再也没有全新的突破,甚至没有找到第二个miRNA。
鲁夫昆等人一度怀疑,miRNA机制可能仅仅只是秀丽隐杆线虫身体内的特例,并不能推广到其它的动物身上。
如果真的是这样,这个研究对人类的贡献,将会变得微乎其微。
虽然,发现第一个miRNA的安布罗斯,在鲁夫昆研究的基础上,继续发现lin-4还能调控lin-28基因[5],以及更多的作用机制,但整体上来说,研究依旧没有脱离秀丽隐杆线虫。
在分子生物学大发现的激荡时代,miRNA的发现,犹如一小块鹅卵石落入水中,不仅没有激起多少水花,还直接被其它研究者所忽视。
一直到2000年,才出现了转机。
加里·鲁夫昆在这一年,发现了同样可以调控线虫发育的第二个miRNA,let-7[6],21个核苷酸长度。
通过相同的作用机制,靶向lin-41基因3’ UTR区,抑制该基因表达来调控线虫的生长发育。
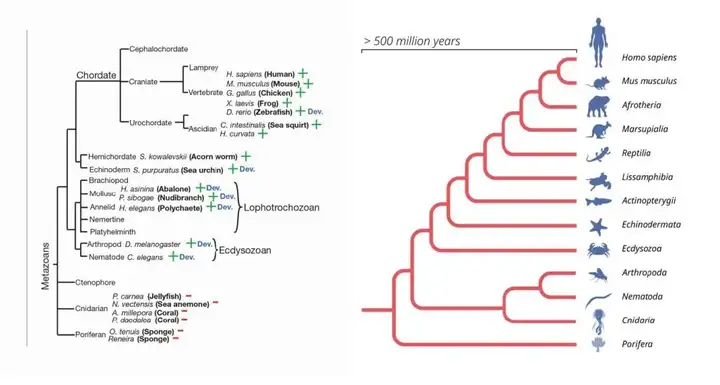
因为let-7无论是在秀丽隐杆线虫这样的线虫体内,还是果蝇这样的节肢动物体内,还是斑马鱼、人类这样的脊椎动物体内都存在,而且还非常的保守。
秀丽影杆线虫这样的原口动物,和人类的亲缘差距大约有6亿多年,也就是说,至少6亿多年前let-7基因就已经出现,而且在这长达6亿年的时间内,几乎都是在发挥差不多相同的机制,没有发生过什么变化。
安布罗斯和鲁夫昆的研究到了这一步,基本上已经完成了miRNA领域的奠基工作。
可以说,未来其它研究者发现miRNA越多、越重要,他们的研究价值和贡献就会进一步提高。
2006年,安德鲁·法尔(Andrew Fire)和克雷格·梅洛(Craig Mello)因为发现RNAi(RNA干扰)沉默基因表达现象而获得诺贝尔奖。在此之后,安布罗斯和鲁夫昆便长期作为诺贝尔奖预测备选之一,一直到今年才获得诺贝尔奖,可能正是和大量的其它miRNA的陆续发现有关。
时至今天,已经鉴定出超过5000种不同的miRNA,人类基因组中的miRNA数量预估超过1900个[7],而一个miRNA并不是作用一个基因,而是成千上万的大量基因。人类为首的哺乳动物身体内,60%的基因都受到miRNA的影响[8][9],而所有脊椎动物共通的miRNA,至少有90个。
可以看出,这个发现,同时也是分子生物学对进化/演化论的有力支持之一。但很明显,对于把演化作为基础的分子生物研究者,并没有兴趣用基础常识与反进化/演化论者对阵,而绝大多数的反进化/演化论者对此又是一无所知。
众多的miRNA,不仅与人类的发育相关,也和人类的各类疾病和治疗息息相关。
分子生物学的绝大多数贡献,其实最终指向的都是医学前沿,miRNA自然也不例外。

例如,一些听力、视力、骨骼、肌肉发育相关的疾病,一些种类的癌症都和miRNA失调有关[10][11][12][13][14]。
虽然在分子生物学大发展的年代,miRNA是一个小小的领域,是一块激起小小水花的小小鹅卵石。但今天它激起的水花,已经成了一个庞大的领域,涉及众多的细小门类。
说不定在未来几十年,在这个领域的细分领域,还可能产生新的诺奖也不一定。
参考^Lee, Rosalind C., Rhonda L. Feinbaum, and Victor Ambros. "The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14." cell 75.5 (1993): 843-854.
^Félix, Marie-Anne, and Christian Braendle. "The natural history of Caenorhabditis elegans." Current biology 20.22 (2010): R965-R969.
^Wightman, Bruce, Ilho Ha, and Gary Ruvkun. "Posttranscriptional regulation of the heterochronic gene lin-14 by lin-4 mediates temporal pattern formation in C. elegans." Cell 75.5 (1993): 855-862.
^Ellis, Hilary M., and H. Robert Horvitz. "Genetic control of programmed cell death in the nematode C. elegans." Cell 44.6 (1986): 817-829.
^Moss, Eric G., Rosalind C. Lee, and Victor Ambros. "The cold shock domain protein LIN-28 controls developmental timing in C. elegans and is regulated by the lin-4 RNA." Cell 88.5 (1997): 637-646.
^Roush, Sarah, and Frank J. Slack. "The let-7 family of microRNAs." Trends in cell biology 18.10 (2008): 505-516.
^Alles, Julia, et al. "An estimate of the total number of true human miRNAs."Nucleic acids research47.7 (2019): 3353-3364.
^Lewis, Benjamin P., Christopher B. Burge, and David P. Bartel. "Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets."cell120.1 (2005): 15-20.
^Friedman, Robin C., et al. "Most mammalian mRNAs are conserved targets of microRNAs." Genome research 19.1 (2009): 92-105.
^Mencia, Angeles, et al. "Mutations in the seed region of human miR-96 are responsible for nonsyndromic progressive hearing loss." Nature genetics 41.5 (2009): 609-613.
^Hughes, Anne E., et al. "Mutation altering the miR-184 seed region causes familial keratoconus with cataract." The American Journal of Human Genetics 89.5 (2011): 628-633.
^de Pontual, Loïc, et al. "Germline deletion of the miR-17∼ 92 cluster causes skeletal and growth defects in humans." Nature genetics 43.10 (2011): 1026-1030.
^Calin, George Adrian, et al. "MicroRNA profiling reveals distinct signatures in B cell chronic lymphocytic leukemias." Proceedings of the National Academy of Sciences 101.32 (2004): 11755-11760.
^Akcakaya, Pinar, et al. "miR-185 and miR-133b deregulation is associated with overall survival and metastasis in colorectal cancer." International journal of oncology 39.2 (2011): 311-318.
^Gibert, Benjamin, et al. "Regulation by miR181 family of the dependence receptor CDON tumor suppressive activity in neuroblastoma." Journal of the National Cancer Institute 106.11 (2014): dju318.
^Hu, Hailiang, and Richard A. Gatti. "MicroRNAs: new players in the DNA damage response." Journal of molecular cell biology 3.3 (2011): 151-158.

用户38xxx54
诺贝尔奖,作为西方文明的荣耀象征,依托科技与拉丁字母而辉煌。但若我们探索新径,深耕华夏文明,或能开创科技新局,使诺贝尔奖的光辉逐渐黯淡。 现代科技源于西方,其语言、文字与逻辑架构为科技探索提供了便利。而华夏民族欲筑科技宏图,需先融合西方标准与规范,这不仅是资源与时间的投入,更是文化认同的挑战,伴随身份迷失与安全风险。许多志士因此受挫,转而寄情山水,期盼在自家话语下编织科技新篇。 然而,我们坚信,每位中华儿女都怀揣科技革新的火种。虽目前科技话语权在西方,但若叙事权归华夏,我们亦将拥有同等优势,让世界倾听东方智慧。未来,西方学界或也将前来汲取华夏国学。