上个世纪,人们发现细胞染色体是由DNA缠绕在蛋白质上组成的,而DNA是遗传基因的载体。此后,DNA逐渐成为了研究的主角,而染色体里的蛋白质却被逐渐淡忘。
然而,如果这些蛋白质没什么作用,生物体为什么还要费很大的心思来维护它们呢?“事出反常必有妖”,科学家们认为,染色体上的蛋白质一定还藏着很多秘密。
日前,中国科学院深圳先进技术研究院甘海云研究员的一项研究,为我们揭示了染色体中的组蛋白在胚胎细胞发育过程中的神秘作用。整个科研过程就如侦探小说一般,推理和细节都拉满!
那么,这些蛋白质到底发挥了怎样的作用呢?我们的故事,要先从一段小剧场开始。
看似没用,也要平均分配!病榻上,一位老者将他的两个儿子叫到床前,指着一堆盒子对他们说道:“孩子们,这是我穷尽一生攒下的100对金项链,为了体现公平,现在完全平均地分给你们。”
于是老人派仆人将包装盒一一打开,将每对项链中的一条分给一个儿子,另一条分给另一个儿子。
两个儿子每人获得了100条项链,笑着站起身来刚要走,这时老者突然叫住了他们:“先别走!”回头喊出两个仆人:“小梅,小珀!你们两个把这些包装盒分给两位公子,记住,一定要平均分配!不然……”
话没说完,老人便与世长辞了。
众人纳闷:“这些不就是很普通的首饰盒吗?而且还是已经用旧了的,有什么用呢?为什么还要平均分呢?难道……”
这段小剧场,描绘的是细胞DNA复制时的一个场景。在真核细胞中,DNA不是裸露地存在于细胞核中的,而是缠绕在一种被称为组蛋白的蛋白质上,就好像项链要收纳在首饰盒里一样。DNA缠绕在组蛋白上,进行进一步折叠压缩之后,就形成了染色体。
DNA复制时,先将染色体一点点解开,把缠绕在里面的旧组蛋白拿掉放在一边,然后有专门的“仆人”(一系列酶)将DNA复制成两份,然后再将复制出来的DNA重新“收纳”到组蛋白上。
此时,那些旧的组蛋白显然不够用了(因为DNA变成了双份,所以需要多一倍的组蛋白来装载),需要新合成一些来用;按照常理来说,新旧组蛋白反正都是组蛋白,混着用也应该没什么大不了的。
但是中国科学院深圳先进技术研究院的甘海云研究员此前在研究中发现,细胞在这个过程中特地安排了两个蛋白质“仆人”——mcm2和pole3/pole4(“小梅”和“小珀”),让他们两人盯着那些旧的组蛋白,小珀负责将旧组蛋白传递给“大儿子”(前导链),小梅负责将旧组蛋白传递给“小儿子”(后随链),确保这些“旧首饰盒”能够平均分配给两条子代染色体。

图1 DNA复制耦联的亲代组蛋白表观信息传递(图片来源:参考文献1)
进一步探索后,2023年9月4日,中国科学院深圳先进技术研究院甘海云课题组在Nature Genetics期刊发表了题为“Symmetric inheritance of parental histones contributes to safeguarding the fate of mouse embryonic stem cells during differentiation”的文章,向我们揭示了这一现象背后的秘密:
如果旧组蛋白分配不均,可能会对细胞分化造成重大影响。
旧蛋白上的新线索近年来,人们逐渐认识到,细胞中的遗传信息调控,除了由DNA控制外,那些之前被认为只有“收纳”作用的组蛋白也发挥着非常重要的作用。简单来说,一颗组蛋白上的各种化学修饰信息(例如甲基化、乙酰化等)能够决定缠绕在它身上的这段基因是要开启还是关闭。
如前所述,DNA复制时需要合成新的组蛋白,而细胞会把旧组蛋白上的修饰信息“复刻”到新的组蛋白上,这样就可以维持基因功能和细胞本身的稳定性。所以之前人们认为,既然可以“复刻”,那么旧组蛋白是否能够平均分配到两条新染色体里,似乎并不重要。
甘海云研究员却不认为是这样,他的推理很直接也很好理解:如果真的不重要,细胞为什么要煞费周章地派专门的蛋白质,来确保旧的组蛋白能够在子代间平均分配呢?
为了研究旧组蛋白的平均分配对后代细胞的意义,甘海云课题组使小鼠的胚胎干细胞中的mcm2蛋白发生了突变而失去正常功能,来观察这一突变带来的结果。结果发现,与正常的胚胎干细胞的后代相比,mcm2突变的干细胞的后代中,组蛋白上的修饰信息已经发生了巨大的变化。
以一种被称作H3K27me3的修饰信息为例,这种修饰信息是在组蛋白一个特定位置贴上3个甲基标签,人们已经知道,如果组蛋白被贴上这种修饰,就表示在它附近的基因会被关掉。
在本次实验中,科学家发现,在mcm2突变掉的干细胞后代中,有些地方莫名其妙地出现了更多的H3K27me3,其他地方却又减少了。也就是说,这些组蛋白调控信息已经全乱掉了。
为了进一步探索H3K27me3升高具体产生了什么影响,科学家想办法找到了H3K27me3升高的组蛋白附近都有哪些基因。通过对这些“受害”基因的“走访调查”,科学家发现这些基因大多参与了胚胎的神经发育过程。
根据我们已知的线索,H3K27me3这种修饰信息会关闭它附近的基因。于是科学家又提出了新的假说:如果负责神经发育的基因附近出现了许多H3K27me3,这应该会使得胚胎的神经发育受到阻碍。

图2 Mcm2突变引发了细胞中H3K27me3修饰信息图样的改变(图片来源:参考文献2)
调查神经发育:顺藤摸瓜如何验证这一推理呢?之前,生物学家们开发了一种方法,可以将胚胎干细胞诱导成为神经干细胞。于是,甘海云研究员的团队也用这种方法来处理含有mcm2突变的胚胎干细胞,如果这种细胞无法像普通细胞那样分化为正常的神经干细胞,那就印证了之前的假说。
结果不出所料:经过诱导后的mcm2突变干细胞,大部分都没能正常地转化为神经干细胞。更进一步的实验发现,如果小鼠的胚胎中只含有突变掉的mcm2,那么这个胚胎根本无法发育成胎儿,而是在发育的很早期就死掉了。

图3 正常的神经干细胞(左一列)与mcm2或Pole3突变的神经干细胞(右边三列)的染色照片,可见这些基因突变之后,细胞无法正常发育(图片来源:参考文献2)
可见,如果胚胎干细胞在DNA复制过程中无法保证旧组蛋白的平均分配,就会导致组蛋白上的调控信息发生异常,最终致死。
调查基因表达:完整证据链上述实验表明,mcm2突变所导致的胚胎神经系统发育失败,很可能是由于突变导致的旧组蛋白分配不均,造成了H3K27me3紊乱,进而抑制了神经发育相关的基因所引起的。
为了拿到“实锤”证据,就必须看一看这些基因是不是真的发生了表达上的变化。于是,科学家进一步观察了mcm2突变细胞的后代,看它们与正常的神经干细胞相比,到底有哪些基因的表达发生了变化。
不看不知道,一看吓一跳:这些突变细胞的后代,毫无规律地表达着数十个相关的基因,有的多表达些,有的少表达些,就像喝醉了一样东倒西歪,没有一个“正常”的。而相比之下,正常细胞所发育成的神经干细胞中,基因的表达非常整齐划一,要多大家一起多,要少就一起少,这样才能保证这些细胞的功能和命运受到严格调控。
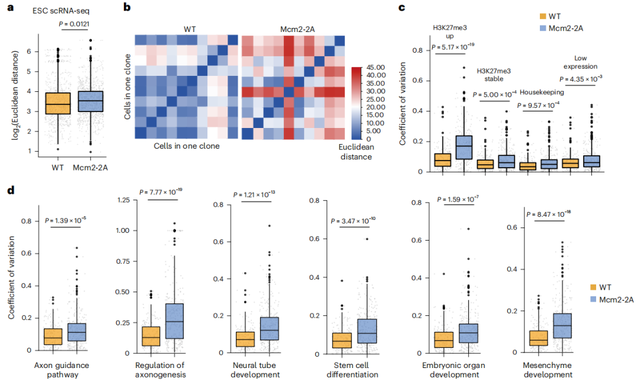
图4 Mcm2突变导致细胞中基因表达出现了变化,这说明Mcm控制的组蛋白平均分配确实会影响基因的表达(图片来源:参考文献2)
这也从根本上验证了科学家们最初的推理:这种mcm2突变所引发的旧组蛋白分配不均,真的能够影响后代细胞里基因的表达,进而影响了胚胎干细胞的命运。
组蛋白:“我来细胞只办三件事,公平!公平!还是公平!”这也回答了前文提出的问题:原来,在DNA复制过程中,旧组蛋白平均分配给两条新染色体,是非常重要的,只有平均分配,才能确保子代细胞能够正常地发育和分化。也正是因为如此,细胞才特地安排“小梅”和“小珀”分工合作,确保旧组蛋白平均分配。
生命是精密而系统的,它不会无缘无故地浪费精力做没必要的事情。感谢科学家们严密的逻辑推理和精妙的实验设计,让我们得以通过这件看似简单的小事,领略到胚胎发育过程中的深层奥秘。
参考文献:
[1] Gan, H. et al. The Mcm2-Ctf4-Polalpha Axis Facilitates Parental Histone H3-H4 Transfer to Lagging Strands. Mol Cell 72, 140-151 e3 (2018)
[2] Wen, Q. et al. Symmetric inheritance of parental histones contributes to safeguarding the fate of mouse embryonic stem cells during differentiation. Nat Genet 55, 1555–1566 (2023). https://doi.org/10.1038/s41588-023-01477-w
[3] T. M. Escobar et al., Active and Repressed Chromatin Domains Exhibit Distinct Nucleosome Segregation during DNA Replication. Cell 179, 953-963.e911 (2019).
[4] C. Yu et al., A mechanism for preventing asymmetric histone segregation onto replicating DNA strands. Science 361, 1386-1389 (2018).
作者:牧心
