肺癌是全球癌症相关死亡的主要原因,目前,免疫治疗与化疗联合应用已成为晚期非小细胞肺癌(NSCLC)的标准一线治疗,但部分患者仍未能受益。传统的疗效预测标志物如PD-L1表达和肿瘤突变负荷(TMB)仅适用于免疫单药,对免疫联合化疗的预测效果有限。近年来,反映基因组多样性的生物标志物在预后和疗效预测方面逐渐显示出潜在的应用前景,如染色体不稳定性(CIN)和瘤内异质性(ITH)等,但其评估受到样本可及性和单点取样偏差的限制。目前,以循环肿瘤DNA(ctDNA)为代表的液体活检已成为监测及指导治疗策略的重要方法,可有效反映基因组突变负荷和肿瘤内异质性,并可通过纵向监测反映肿瘤的动态变化,为NSCLC免疫联合化疗的精细化分层策略提供了重要的探索价值和应用潜力。为应对这一挑战,中国医学科学院肿瘤医院王洁教授带领团队成功构建基于ctDNA的免疫分型,助力NSCLC精准免疫治疗决策。
2024年9月9日,王洁/王志杰教授团队在Cancer Cell(IF:48.80)在线发表了题为“Circulating tumor DNA-based stratification strategy for chemotherapy plus PD-1 inhibitor in advanced non-small-cell lung cancer”的前瞻性转化研究成果。该研究对全国多中心、III期、随机对照临床研究(CHOICE-01)进行了动态标本的前瞻性收集及全景基因组特征的整合分析,建立了一种基于ctDNA的整合型基因组特征的外周血基因组免疫分型(blood-based genomic immune subtypes,bGIS)方法,为晚期NSCLC一线免疫联合化疗精细化分层提供了新策略,并为未来基于该分层策略的进一步前瞻性研究指明了方向。

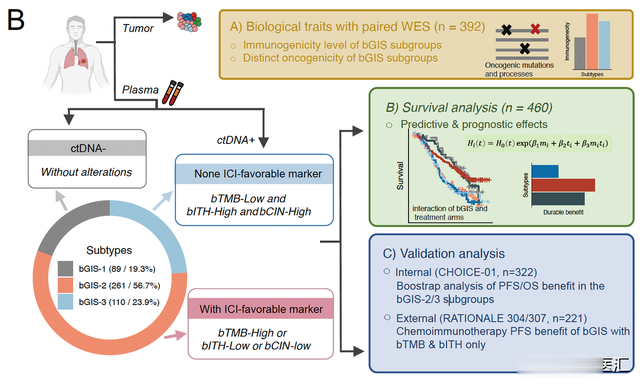
研究对CHOICE-01临床研究中460名患者治疗前、治疗期间以及进展后的动态ctDNA样本,进行了高通量二代测序(NGS)及低通量全基因组测序(Low-Pass WGS),同时对393个配对基线组织样本进行全外显子组测序(WES)。

通过对基因组特征及生存预后的综合分析,主要发现如下:
1、治疗前ctDNA阴性者的整体生存预后良好,该类患者在化疗基础上增加PD-1抑制剂带来的长期生存受益有限;为进一步探索分层策略,研究团队聚焦于基线ctDNA阳性人群,鉴定出几类可预测免疫联合化疗疗效的分子特征,包括基于ctDNA的肿瘤突变负荷(bTMB)、肿瘤内异质性(bITH)和染色体不稳定性(bCIN)等。研究发现, bTMB-high、bITH-low和bCIN-low与免疫联合治疗带来的良好生存预后相关,然而任何单一分子特征的预测效能均存在局限。
2、研究团队整合上述分子特征,建立了一种基于ctDNA的综合分型策略——外周血基因组免疫分型(bGIS)。基于此,将患者分为三个亚组:基线ctDNA阴性亚组(bGIS-1:ctDNA-)、携带上述任何一个可预测免疫联合治疗获益的分子特征亚组(bGIS-2:bTMB-high或bITH-low或bCIN-low)以及不携带任何上述分子特征的亚组(bGIS-3:bTMB-low或bITH-high或bCIN-high),该bGIS模型可有效区分在化疗基础上增加免疫治疗的获益者和未获益者。
3、该研究同时纳入了另外两项和CHOICE-1研究患者特征、治疗模式和测序平台完全一致的全国多中心III期随机临床试验作为独立验证队列,有效验证了bGIS分型策略的可重复性和可靠性。此外,通过对配对肿瘤组织的WES分析,研究亦描绘了不同bGIS亚组的内在分子特征,展示了三组之间显著差异的肿瘤发生特征和抗原呈递能力,从内在机理和分子机制上证明了该分层策略的合理性。
4、此外,研究团队通过对治疗期间外周血ctDNA的动态监测,定义了“ctDNA response”概念,发现ctDNA response可进一步在影像学评效的基础上带来额外的生存预后预测价值。
综上,该项转化研究作为首个基于“免疫联合化疗”治疗模式下晚期NSCLC的多维度、大规模基因组生物标志物探索,建立了ctDNA特征与肿瘤生物学特征之间的直观联系,识别了几种可预测免疫联合化疗疗效的关键基因组特征,并构建了基于ctDNA的晚期NSCLC精准免疫治疗分层管理策略。

值得注意的是,该分层策略中所涉及的指标,均可通过外周血无创检测的方式获得,进一步促进无创分型向精细化免疫治疗的转化,这也是王洁教授团队近20年聚焦ctDNA分子分型系列研究的拓展和延伸。这项研究为进一步探索晚期NSCLC免疫联合治疗的精细化分层策略提供了新视角,并为基于该分层策略的前瞻性研究提供了新方向。
中国医学科学院肿瘤医院王洁教授、王志杰教授为该论文的共同通讯作者;徐佳晨主治医师、万蕊主治医师、蔡怡然博士、蔡尚利博士为共同第一作者。
