*仅供医学专业人士阅读参考
点击右上方“关注”,准时接收每日精彩内容推送。
生物材料与动态生物组织之间的界面对于疾病诊断和疗养至关重要。目前促进紧密生物界面的策略主要依赖于具有低弯曲刚度的薄柔性膜,如为柔性生物电子学开发的膜,以及添加生物相容性或生物可降解粘合剂。最新研究表明,粘弹性聚合物或水凝胶可提供保形生物界面,改善信号传输和生物相容性。这些整体或相互连接的构造,如网状装置或水凝胶膜,可以很容易地驻留在器官的靶点上,与靶点的表面曲率保持一致。材料生物界面是疾病诊断和调理的关键。整体式生物界面更容易实现,而分布式和焦点式界面往往更具动态性,侵入性更小。
来自美国伊利诺伊大学芝加哥分校的Petr Král团队和来自美国芝加哥大学的Jiping Yue和Bozhi Tian团队合作利用天然前体,构建了一个颗粒释放水凝胶平台,该平台展示了从整体到病灶不断演化的生物界面,从而扩展了传统整体或病灶生物界面的形式、传递方法和应用领域。单个颗粒被嵌入反应性水凝胶基质中,然后被转换成各种宏观形状,如绷带和生物电子-凝胶混合物,以增强宏观操控性。这些颗粒可以从宏观形状中释放出来,并在体内外建立病灶生物粘附,分子动力学模拟揭示了粘附机制。通过不断发展的设计,本研究证明了颗粒释放型水凝胶可有效调理溃疡性结肠炎、愈合皮肤伤口和减少心肌梗塞。此外,本研究还展示了将颗粒释放型水凝胶融入柔性心脏电生理学映射装置后,装置的操控性和生物粘附性都得到了改善。这项研究提出了一种构建动态生物界面的方法。相关工作以题为“Monolithic-to-focal evolving biointerfaces in tissue regeneration and bioelectronics”的文章发表在2024年01月11日的国际期刊《Nature Chemical Engineering》。

1. 创新型研究内容
本研究表明,动态水凝胶复合材料可在生理环境中释放细胞大小的颗粒,用于再生医学和生物电子学,这也是人们在开发水凝胶人造细胞过程中长期追求的目标。整体到病灶的演化过程可使复合材料同时利用整体和病灶生物界面的特性和功能(图 1a)。水凝胶复合材料使用明胶和壳聚糖作为水凝胶基质,既能适应生物环境,又能促进材料的宏观塑形和操作。此外,水凝胶复合材料由细胞尺度的可释放颗粒(即颗粒状水凝胶)组成,可在体内和体外形成病灶生物粘附,并在最后降解达到效果(图 1a)。
颗粒释放型水凝胶(图 1a)的释放-粘附-降解动力学是通过以下方法实现的:(1)调节明胶和壳聚糖基质的粘弹性或酶解以实现颗粒释放;(2)受药物启发对淀粉/壳聚糖颗粒进行表面改性(图 1b)以建立病灶粘附;以及(3)利用天然存在的可生物降解的生物聚合物和生物大分子。除了用于注射或涂覆的传统凝胶形式外,颗粒释放型水凝胶还可以产生绷带状结构(图 1c)、生物电子-水凝胶复合材料以及水凝胶或气凝胶微针结构。复合材料的初始宏观形态可保护脆弱的电子元件,并促进生物电子器件的灵活部署(图 1d、e)。此外,整体基质还能提供一个可调节的粘弹性环境,以实现缓慢而灵敏的颗粒释放。分散后,表面经过修饰的微米级颗粒将形成分散的生物界面。与整体生物界面相反,这些分散界面有可能促进水、电解质和氨基酸等小分子的传输(图 1a)。此外,天然生物聚合物随后的生物降解也将促进组织的再生恢复。通过这种不断发展的机制,颗粒释放水凝胶可有效控制右旋糖酐硫酸钠(DSS)诱发的结肠炎症状,加速皮肤伤口愈合,促进心脏组织再生,并利用生物电子设备绘制心脏活动图(图 1a、f)。这种不断发展的系统集成了当前整体和病灶生物界面材料和设备的优点和应用领域。

图1 动态水凝胶系统形成用于诊断和调理的颗粒生物界面
【可调粘弹性使颗粒释放反应灵敏】
为了构建释放颗粒的水凝胶,本研究使用了天然提取的淀粉、壳聚糖和明胶。明胶形成一个三维水凝胶网络,将淀粉/壳聚糖颗粒限制在其中,以便进行最初的宏观操作。释放后,细胞级颗粒(图 1a)将渗透到传统笨重水凝胶不易进入的深层狭窄组织区域(如伤口部位、肠腔)。本研究首先关注了颗粒释放水凝胶的形态和动力学特征。据报道,壳聚糖通过分子间相互作用与淀粉颗粒相互作用。利用金属标记和同步辐射三维 X 射线荧光层析技术,本研究检测了单个淀粉/壳聚糖颗粒的结构,发现壳聚糖在淀粉基颗粒表面呈斑块状分布(图 2a)。由于壳聚糖的胺基比淀粉的羟基更易反应,因此表面附着的壳聚糖为进一步改性提供了更容易的化学锚点。正如共聚焦显微镜和扫描电子显微镜所显示的那样,嵌入水凝胶基质中的颗粒分布均匀(图 2b)。
最初的生物界面构建将受益于具有类似组织机械性能的保形生物材料。本研究制备的颗粒释放水凝胶具有较高的含水量(>70%)、适当的柔软度(杨氏模量为 80 kPa,与伤口组织和心肌相似)和适度的拉伸性(最大应变>100%)。颗粒释放型水凝胶还表现出类似组织的粘弹性行为,表现为应变和频率相关模量、快速应力松弛和较大的机械滞后(图 2c),这在很大程度上有助于与曲线表面形成保形界面。所观察到的粘弹性行为主要归因于颗粒在外部应力作用下的重新排列以及颗粒在基质中的微结构重组,从而增强了能量耗散。

图2 颗粒释放水凝胶显示出动态机械行为和颗粒传输响应性
【针对病灶生物粘附的药物启发表面修饰】
通过分子动力学模拟,本研究发现具有快速吸收和亲油性的药物分子,如阿司匹林,可以通过降低相互作用能来促进壳聚糖与脂质双分子层之间的结合(图 3a)。具体来说,一条阿司匹林修饰的壳聚糖链与 DMPC膜之间的时间平均每链相互作用能为ΔΕ = -5.67 ± 2.20 kcal mol-1,而未修饰的壳聚糖与 DMPC 膜之间的平均相互作用能为 -3.52 ± 1.79 kcal mol-1。本研究利用碳二亚胺化学合成了阿司匹林-壳聚糖生物共轭物(图 3b),并形成了阿司匹林修饰的壳聚糖/淀粉颗粒(AS)。核磁共振和傅立叶变换红外光谱测量证实了合成的成功。为了研究不同颗粒与不同生物成分之间的内在亲和力(图 3c),本研究采用了不含明胶水凝胶基质的水性颗粒悬浮液,发现 AS 表现出最强的亲和力。首先,本研究在体外进行了流动粘附试验,流体流动的剪切应力模拟了人体腔内的剪切应力。具体来说,当 AS 流过不同的生物成分(图 3c),包括分子组合(磷脂层,图 3c(i);胶原层,图 3c(ii))、体外细胞单层(红细胞,图 3c(ii))时,AS 比未改性淀粉/壳聚糖颗粒(SC)和纯淀粉颗粒(淀粉)显示出更高的粘附率。其次,在体外实验中,当 AS 流经经 DSS 处理的溃疡性结肠上皮(图 3c(vii))或皮肤伤口床(无表皮,真皮暴露;图 3c(viii))时,其保留率高于 SC。值得注意的是,本研究还发现颗粒状复合材料的大小和形状对基质上的保留率没有显著影响。AS 在体内小鼠肠道中的滞留期也延长了,这表明它具有潜在的调理用途。本研究还进行了宏观搭接-剪切粘附试验,证明阿司匹林改性增加了壳聚糖的粘附强度。用烟酸和丁酸修饰的淀粉/壳聚糖颗粒(口服吸收良好的药物分子)也显示出对结肠上皮和皮肤伤口床的亲和力,尽管效率低于 AS。这些结果表明,生物大分子的化学共轭可以增强基于颗粒的病灶生物界面的粘附性/亲和性,而且良好的口服吸收通常可被视为潜在分子修饰的“定性”预评估因素。
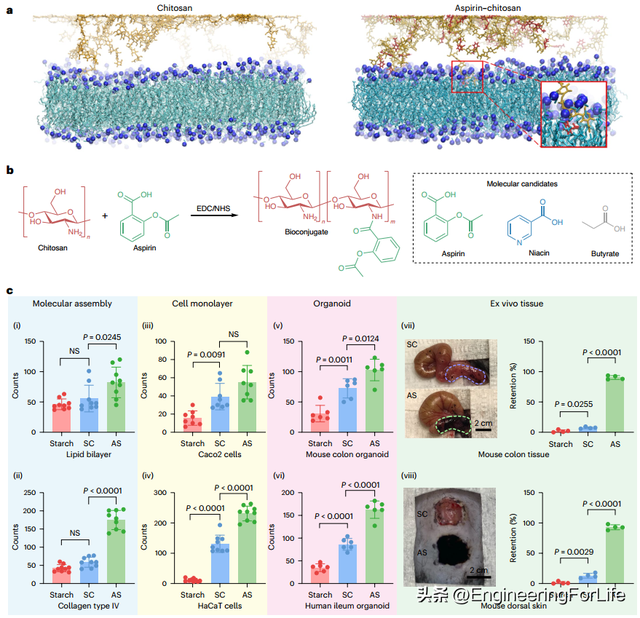
图3 用生物活性分子对颗粒复合材料进行化学修饰可增强生物亲和力
【溃疡性结肠炎模型的调理效果】
本研究试图确定附着的生物分子结合颗粒及其在受损组织表面的部分降解产物所形成的生物物理屏障是否有助于疾病的恢复(图 4a)。结肠炎是一种原因不明的结肠慢性炎症。目前调理溃疡性结肠炎的方法仅限于控制症状,但这并不能解决根本原因,包括肠道屏障受损和肠道微生物群失调。为了评估颗粒释放水凝胶(图 4b)的调理效果,本研究使用 DSS 诱导的结肠炎模型进行了一系列临床前评估。DSS 诱导的结肠炎模型的临床和组织学特征与人类溃疡性结肠炎相似,包括不良症状(如出血、腹泻)、上皮屏障功能丧失、肠道炎症和宿主-肠道微生物群失调,因此被广泛用于体内评估。利用这种动物模型,本研究观察到从口服阿司匹林改性颗粒释放水凝胶(AGH)中释放出的颗粒粘附在经 DSS 处理的结肠上皮细胞上(图 4c)。这与通过流动粘附试验观察到的 AS 的体外粘膜亲和性一致(图 3c)。本研究结果表明,颗粒释放水凝胶复合材料在通过结肠生物界面控制 DSS 引起的溃疡性结肠炎方面具有广阔的前景。在调理啮齿动物结肠炎的不良症状方面,与未改性但仍可动态/释放的颗粒释放水凝胶(DGH)相比,AGH 在体重减轻、结肠长度、粪便含水量和出血评分方面显示出更好的调理效果(图 4d)。非释放型聚乙烯醇基质水凝胶(PVA)或非颗粒释放型水凝胶(NGH;含有相同的化学成分)没有显示出类似程度的调理效果。单独使用颗粒对小鼠体重减轻和结肠缩短有积极影响,但对粪便含水量或出血评分没有影响。此外,只有 AGH 能明显改善结肠组织学损伤,而 AS、PVA 或 NGH 却不能(图 4e,f),这表明 AGH 可形成一种调理生物界面,保护结肠上皮免受病理损伤。因此,颗粒释放过程和分布式病灶生物界面的形成可能在调理溃疡性结肠炎中具有重要作用。

图4 AGH 系统可调理 DSS 引起的体内溃疡性结肠炎
【皮肤伤口模型的调理效果】
用于调理干预的生物界面也可在受损的皮肤上皮细胞上实现。皮肤伤口愈合涉及上皮细胞的迁移、增殖和分化--其行为可能受基底材料的孔隙率和降解率的调节。在皮肤伤口闭合模型中(图 5a),具有粘弹性的颗粒释放水凝胶与不规则的皮肤伤口床吻合,建立了最初的生物界面。随着时间的推移,基质内的阿司匹林改性颗粒缓慢释放,在皮肤伤口上建立起颗粒状生物界面(图 5b)。释放出的颗粒与皮肤伤口床有很高的亲和力,这与体内流动粘附/亲和力测试结果一致(图 3c)。本研究对伤口进行了为期 7 天的监测,观察到 AGH 处理的小鼠伤口愈合(图 5c,d)。PVA 和 NGH 处理的小鼠也显示出促进伤口愈合的能力。然而,与 AGH 组相比,PVA 和 NGH 组的调理效果较弱(图 5e),这支持了颗粒释放过程和病灶生物界面的效用。与对照组相比,DGH 处理的小鼠伤口愈合情况也有所改善,但调理效果不如 AGH 处理组强(图 5e)。调理效果的差异可能是由于表面修饰颗粒的生物亲和力更高(图 3c)。单独使用 AS 也有助于皮肤伤口愈合(图 5e)。然而,与 AGH 相比,其调理效果较差。这部分归因于 AGH 中的初始整体基质,它确保了颗粒的持续释放,并增强了对独立颗粒的操作,防止了调理过程中的材料流失。与 Tegaderm 敷料相比,AGH 似乎在伤口愈合方面显示出潜在的增强调理效果。
【生物电子心脏记录和组织再生】
不断发展的水凝胶还可以与生物电子装置集成,实现心脏组织的电生理记录和组织再生(图 6a)。利用凝胶浇注方法,本研究将用于心脏时空映射的 16 通道网状电子装置与 AGH 集成在一起。该混合电子装置在 16 个通道上以 1 kHz 的频率记录平均阻抗为 36.4 Ω cm-2 的电信号。为了证明混合电子装置的实用性,本研究将其与 Langendorff 仪器中的体外心脏连接,测量心外膜心电图(图 6b)。与体表心电图相比,心外膜心电图能提供精确的定位,从而识别异常的电通路,这是指导针对性干预的一个关键方面。独立的柔性网状装置天然脆弱,不容易部署到活体组织表面。然而,混合电子装置在宏观手动操作时要坚固得多(图 1d)。

图6 颗粒释放水凝胶促进网状生物电子心电图记录和心肌梗塞调理
2. 总结与展望
可释放颗粒的水凝胶有望成为一种不断发展的生物界面平台,有望应用于炎症性肠病调理疗、组织再生和改进柔性生物电子操作。颗粒释放后,可形成瞬态病灶生物界面,从而克服静态整体材料所面临的挑战,如低时空分辨率、缺乏最佳生物相容性和/或信号转导及分子传输效率低下等。通过将颗粒封装在反应性水凝胶基质中,本研究改善了材料/设备在环境条件下的宏观处理,并实现了调理和粘合颗粒的反应性释放。受药物分子的细胞或组织亲和性启发,改性颗粒的病灶粘附机制可扩展到生物医学应用中的各种整体或其他病灶粘附界面。在水凝胶复合材料中加入了几种食品级生物聚合物,以改善粘弹性行为,并在调理溃疡性结肠炎、皮肤伤口和梗塞的心脏组织方面产生直接的调理效果。由于用于构建不断发展的生物界面的所有材料都来自天然生物资源(即生物聚合物和天然生物大分子,如阿司匹林),颗粒释放水凝胶可能为解决某些生物医学或生物物理问题提供了一种更具成本效益和可持续性的方法。这项研究提出了一种设计规则,它结合了当前整体生物界面系统和焦点生物界面系统的优点和应用领域。
了解更多
关注“EngineeringForLife”,了解更多前沿科研资讯~

