导语:胰腺癌是一种极具侵袭性的恶性肿瘤,其死亡率极高,且大多数胰腺癌患者确诊时已为晚期。KRAS基因突变是胰腺导管腺癌(PDAC)的主要驱动因素,而CDKN2A基因的失活则进一步促进了PDAC的发展。尽管已有多种CDK4/6抑制剂被批准用于治疗其他癌症,但它们在PDAC中的临床效果有限。本文通过结合CRISPR-Cas9筛选和蛋白质活性分析,探索了提高CDK4/6抑制剂在治疗KRAS突变型PDAC中疗效的新策略。
研究背景:
胰腺导管腺癌(PDAC)是美国癌症相关死亡的第三大原因,其治疗手段有限,预后极差。PDAC的分子基础已被阐明,其中KRAS基因的突变激活是PDAC发展的关键起始步骤,而CDKN2A肿瘤抑制基因的失活则进一步促进了PDAC的恶性生长。CDKN2A基因编码的p16INK4A蛋白通过抑制CDK4和CDK6来调控细胞周期,其在PDAC中的丢失导致RB蛋白的超磷酸化,进而促进细胞增殖。因此,恢复p16INK4A的功能,使用CDK4/6抑制剂来治疗PDAC具有潜在的治疗价值。然而,尽管在临床前研究中显示出了一定的抗肿瘤活性,CDK4/6抑制剂在PDAC中的临床效果仍然令人失望。
研究方法:
为了增强CDK4/6抑制剂在PDAC中的抗肿瘤活性,研究者们采用了多种方法。首先,通过siRNA技术敲减CDK4或CDK6,评估了PDAC细胞对CDK4/6抑制的敏感性。接着,使用CRISPR-Cas9基因编辑技术,对2240个基因进行了功能缺失筛选,以鉴定那些能够增强CDK4/6抑制剂活性的基因。此外,还利用蛋白质反向相阵列(RPPA)技术监测了CDK4/6抑制剂处理后PDAC细胞信号通路的变化。最后,通过体内外实验验证了筛选出的基因和药物组合对PDAC细胞生长的影响。
研究结果:
研究发现,单独使用CDK4/6抑制剂在PDAC中的效果有限,但与ERK MAPK抑制剂(ERKi)联合使用时,能够协同抑制PDAC细胞的生长。这种协同作用通过阻断CDK4/6i诱导的ERK、PI3K、抗凋亡信号和MYC表达的补偿性上调来实现。基于这些发现,研究人员启动了一项I期临床试验,以评估ERKi ulixertinib与CDK4/6i Palbociclib联合治疗晚期PDAC患者的疗效。CRISPR-Cas9筛选揭示了一系列功能多样的基因,这些基因的缺失增强了CDK4/6i的生长抑制活性,这些基因主要涉及细胞周期调控、PI3K-AKT-mTOR信号、SRC家族激酶、HDAC蛋白、自噬激活途径、染色体调控和维护以及DNA损伤和修复途径。此外,研究还发现了一些基因的缺失可能赋予PDAC细胞对CDK4/6抑制的抗性,如RB1、PTEN和FBXW7。
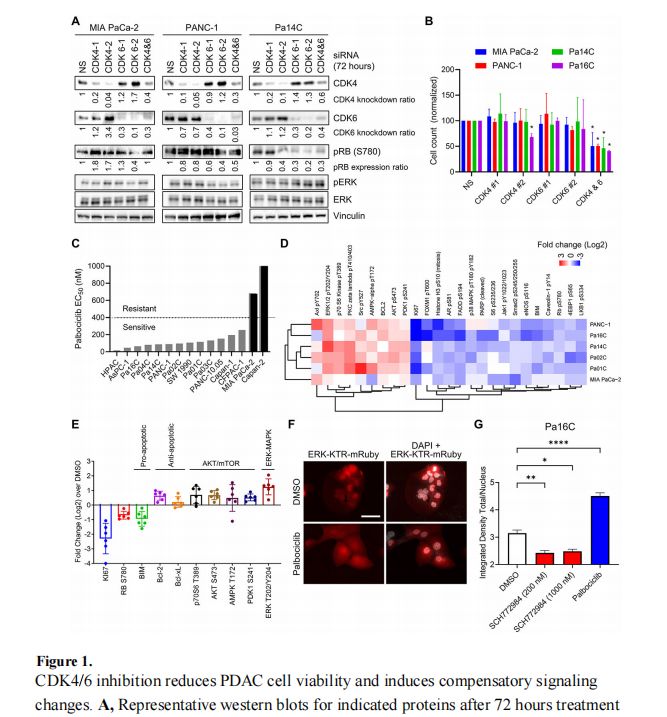
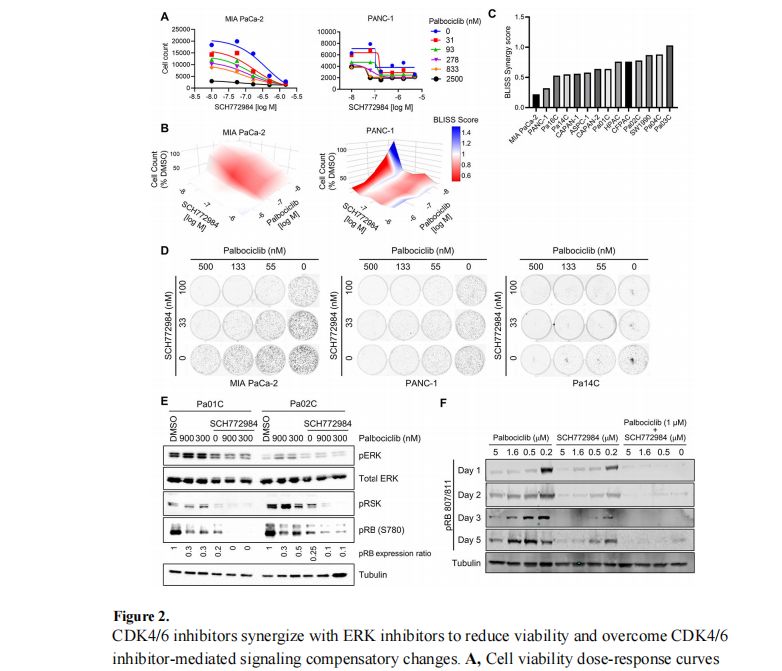
总结讨论:
本研究通过CRISPR-Cas9筛选和蛋白质活性分析,揭示了多种可以与CDK4/6抑制剂联合使用的新型治疗组合,这些组合可能对PDAC患者具有临床益处。特别是,CDK4/6抑制剂与ERK抑制剂的联合使用,不仅在体外试验中显示出了显著的协同抗肿瘤效果,而且已经在I期临床试验中得到了验证。此外,研究还发现了一些可能的抗性机制,为未来的治疗策略提供了重要的信息。尽管如此,还需要进一步的研究来确定这些发现在临床上的适用性和有效性,并且需要考虑如何克服可能出现的抗性问题。总的来说,这项研究为KRAS突变型PDAC的治疗提供了新的视角,并为开发更有效的联合治疗策略提供了坚实的基础。
参考文献:
Goodwin CM, Waters AM, Klomp JE, et al. Combination Therapies with CDK4/6 Inhibitors to Treat KRAS-Mutant Pancreatic Cancer[J]. Cancer Res. 2023;83(1):141-157.
编辑:十六
二审:清扬
三审:碧泉
排版:半夏
