
论文荐读
D-甘露糖异构酶的酶学性质探究和热稳定性改造
作者:
沈玲1,2,3 赵丽婷1,2,3 沈昱3 陈磊1,2,3 李军训4 顾正华1,3 李由然1,3 石贵阳1,2,3 丁重阳1,2,3*
单位:
1.江南大学 粮食发酵与食品生物制造国家工程研究中心
2.江南大学 糖化学与生物技术教育部重点实验室
3.江南大学 生物工程学院
4.山东泰山生力源集团股份有限公司
基金项目:
轻工业技术与工程国家一流学科计划项目(LITE2018-22)
摘要&关键词
摘要:D-甘露糖异构酶可以催化D-果糖与D-甘露糖之间的相互转化,在D-甘露糖的生物酶法制备中具有应用前景,但是目前报道的D-甘露糖异构酶热稳定性较差,无法满足工业生产高温的需求。该研究将大肠杆菌(Escherichia coli) Dh5α来源的D-甘露糖异构酶异源表达后进行酶学性质研究,并对其进行热稳定性改造。研究结果显示D-甘露糖异构酶的最适反应温度为30 ℃,最适反应pH值为6.0~7.0,Km、kcat和kcat/Km分别为963.4 mmol/L、1.38 s-1、1.4×10-3L/(mmol·s)。通过理性改造该研究获得了一株热稳定性显著提高的突变体A241P/A116V/G253A/Q379P,其最适反应温度提高了15 ℃,在50 ℃条件下,半衰期为野生型的33倍,相对酶活力比野生型高60%。分子动力学模拟分析表明脯氨酸的引入和疏水作用的增强,提高了蛋白质的刚性,从而使热稳定性提高。该研究通过对主流来源的D-甘露糖异构酶进行酶学性质探究及热稳定性改造,为生物酶法高效制备D-甘露糖提供了理论依据,为D-甘露糖异构酶结构-稳定性的研究奠定基础。
关键词:D-甘露糖异构酶;异源表达;酶学性质;热稳定性改造;分子动力学模拟
主要结论
本研究对大肠杆菌Dh5a来源的D-甘露糖异构酶进行了异源表达并对其酶学性质进行表征,其酶学性质探究结果显示:最适温度为30 ℃,最适pH值为6.0~7.0,当以D-果糖为底物时,Km为963.4 mmol/L,反应最大速率Vmax为12.66 mmol/(L·min)。


A-温度;B-pH
图1 温度、pH对D-MIase酶活力的影响
本研究通过AlphaFold构建D-甘露糖异构酶的蛋白质结构模型,利用FireProt网站,在耐热多点突变体的计算设计板块进行模拟计算,获得突变位点后并进行迭代组合突变,最终获得了热稳定性提高显著的突变体M4(A241P/A116V/G253A/Q379P),与野生型相比,其在50 ℃条件下酶活力提高了60%,在50 ℃的半衰期提高了32倍,最适反应温度也提高了15 ℃。

图2.迭代突变阶梯图
本研究通过分子动力学模拟对最优突变体与野生型的结构进行分析比较,发现脯氨酸的引入和疏水作用的增强,提高了蛋白质的刚性,从而使D-甘露糖异构酶的热稳定性提高。本研究获得的突变体M4其热稳定性提升的同时,酶活也提高了60%,使得生物酶法应用于工业化生产D-甘露糖的可能性增加,为生物酶法高效制备D-甘露糖提供了理论依据,为D-甘露糖异构酶结构-稳定性的研究奠定基础。

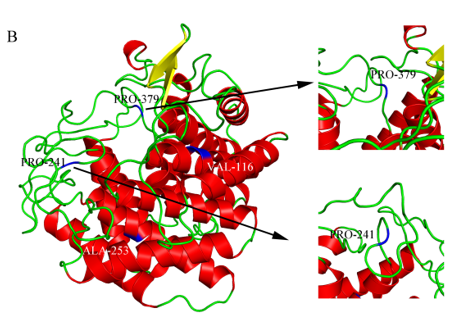

A-WT与M4的RMSD值和RMSF值;B-突变位点在D-MIase三维结构中的位置(蓝色标出);C-WT中ALA-116与TRP-94的相互作用力;D-M4中VAL-116与TRP-94的相互作用力;E-WT中GLY-253与周围氨基酸之间的作用力;F-M4中ALA-253与周围氨基酸之间的作用力
图3 WT与M4的RMSD、RMSF值和突变位点与周围氨基酸的相互作用力示意图
注:黄色虚线为氢键,粉色虚线为p-烷基疏水作用力,紫色虚线为p-s疏水作用力。
团队介绍

江南大学粮食发酵工艺与技术国家工程实验室
发酵过程工程研究团队
通信作者

丁重阳,江南大学生物工程学院教授、博士生导师,长期从事基于食药用真菌的活性天然产物与酶资源的开发与应用,为中国农业生物技术学会常务理事,获江苏高校“青蓝工程”中青年学术带头人,江苏省“六 大人才高峰”高层次人才计划等项目资助。近五年来,主要承担《发酵工艺原理与技术》等课程的讲授工作;主持承担国家、省部及企业课题16项,以第一发明人获授权发明专利16件,SCI论文30余篇;申请国家发明专利40余项,其中国际专利8项,已获授权国际专利7项,中国发明专利30余项;出版著作及教材1本。获教育部科技进步二等奖1项(排名第一)。
本文图片来源于文章原文及作者团队。
