论文荐读
番茄红素β-环化酶和新黄质合酶功能差异关键氨基酸的发掘
作者:
王丽1,2,赵子龙1,2,刘振1,2*,毛相朝1,2,3
单位:
1.中国海洋大学食品科学与工程学院,青岛市食品生物技术重点实验室
2. 中国轻工业水产品生物加工重点实验室
3. 青岛海洋科学与技术试点国家实验室,海洋药物与生物制品功能实验室
基金项目:
国家重点研发计划项目(2021YFE0107500)
摘要&关键词
摘要:
酶是天然存在的高效催化剂。长期的进化过程产生了诸多的同源酶,同源酶的序列相似高却有不同的功能,而导致功能差异的原因也倍受关注。类胡萝卜素合成过程中,番茄红素β-环化酶(Lycopene β-cyclase,LCYB)和新黄质合酶(Neoxanthin synthase,NSY)序列高度相似但对番茄红素的环化功能不同,且并未有研究报道导致环化差异的原因。因此该研究选用氨基酸序列相似性为88.2%的枸杞来源LyLCYB和番茄来源SoNSY为研究对象,通过将基因soNSY的片段替换为lyLCYB对应位置的片段构建不同的嵌合体基因,并且利用定点突变策略构建差异位点的点突变蛋白,将改造后的基因在大肠杆菌中异源表达,测定其番茄红素环化活性。最终发现了219位点是导致LyLCYB和SoNSY番茄红素β-环化功能差异的关键氨基酸,为进一步探究影响其他来源的LCYB和NSY功能差异提供了理论支持。
关键词:番茄红素β-环化酶;新黄质合酶;嵌合体;差异氨基酸;大肠杆菌异源表达
主要结论
本研究通过在E. coli BL21(DE3)中构建类胡萝卜素的异源表达系统,利用嵌合体和定点突变的方式探究了导致类胡萝卜素合成酶LyLCYB和SoNSY番茄红素环化功能差异的关键氨基酸位点。全基因合成lyLCYB和soNSY后,在E. coli BL21(DE3)异源表达证明LyLCYB可以将番茄红素环化为β-胡萝卜素,而SoNSY则不具备该功能。通过NCBI等网站对含有498个氨基酸的LyLCYB和SoNSY序列进行分析。结果表明,两者均没有跨膜结合域,且两个序列都含有相同氨基酸位置的叶绿体转运肽(chloroplast transit peptides, cTP)、FAD结合区域、环化保守基序和蛋白N端非保守区域。通过敲除实验证明,cTP不影响LyLCYB和SoNSY酶功能的表达,后续实验均在敲除了cTP的QLyLCYB和QSoNSY上进行。
基于QLyLCYB和QSoNSY两序列有59个差异的氨基酸位点(图1-a),首先采用构建嵌合体的方式---将QSoNSY序列的部分肽段替换为对应的QLyLCYB氨基酸序列,分区域判断关键氨基酸位点所在的位置,逐步缩小关键氨基酸位点的范围。构建了如图1-b所示的四个嵌合体质粒,分别是:pTac15K-QLyLCYBa、pTac15K-QLyLCYBb、pTac15K-QLyLCYBc、pTac15K-QLyLCYBd,将这四个嵌合体质粒导入产番茄红素的E. coli BL21(DE3)中,经过发酵分析后,在含有pTac15K-QLyLCYBa、pTac15K-QLyLCYBb、pTac15K-QLyLCYBd这三个质粒的菌株中均检测到了番茄红素和β-胡萝卜素,而含有pTac15K-QLyLCYBc质粒的菌株发酵产物中,仅发现了番茄红素(图1-c)。

1:β-胡萝卜素;2:番茄红素
图1 基于LyLCYB和SoNSY序列比对构建的嵌合体功能分析
Fig.1 The analysis of chimeras’ function constructed based on sequences alignment of LyLCYB and SoNSY
上述实验结果表明,导致QLyLCYB和QSoNSY对番茄红素环化差异的关键氨基酸位点在pTac15K-QLyLCYBd质粒替换的这一部分上。因此继续构建了如图2-a所示的3个质粒:pTac15K-QLyLCYB-FH、pTac15K-QLyLCYB-MID、pTac15K-QLyLCYB-TSH。验证后发现,仅含有pTac15K-QLyLCYB-FH质粒的菌株发酵产物中检测到了β-胡萝卜素,其他两个在发酵产物中没有发现β-胡萝卜素(图2-b)。依据上述的实验结果,将含有关键氨基酸的肽段范围缩小至FH处,即影响番茄红素环化功能的关键氨基酸在209到279之间。
为了进一步确定差异的氨基酸位点,将QSoNSY和QLyLCYB在FH区域中的10个差异氨基酸位点209、210、219、223、229、230、241、243、256和276定点突变(图2-c),即将QSoNSY上的差异位点突变QLyLCYB的对应位置的氨基酸。异源表达后发现在含有soNSY-D219G基因的菌株中,检测到了β-胡萝卜素(图3),这表明改造后的soNSY-D219G具备了番茄红素β-环化功能。而剩余9个突变位点的发酵产物均只检测到了番茄红素。在此基础上,突变了LyLCYB的219位点,构建了pTac15K-LyLCYB-G219D质粒,在转化分析后发现其失去了番茄红素的环化功能,在发酵产物中仅检测到了番茄红素。上述的实验结果表明,219位点是导致LyLCYB和SoNSY对番茄红素环化功能差异的关键氨基酸位点。
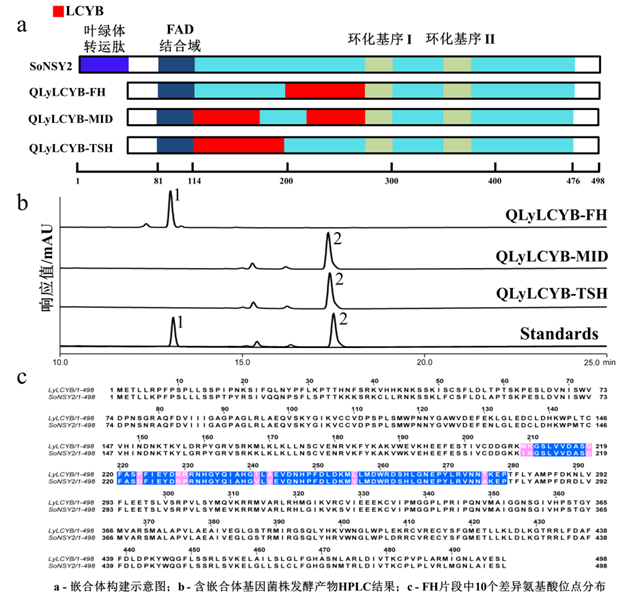
1:β-胡萝卜素;2:番茄红素
图2 影响环化功能的关键肽段FH的发掘
Fig.2 Discovery of key peptides FH affecting cyclization function

1:β-胡萝卜素;2:番茄红素
图3 基因QlyLCYB-G219D和QsoNSY-G219D番茄红素β-环化活性分析结果
Fig.3 Results of functional analysis of lycopene β-cyclization of the genes QlyLCYB-G219D and QsoNSY-G219D
团队介绍

海洋食品生物技术与工程研究室
研究室主要研究领域为应用酶工程、代谢工程和发酵工程等生化工程技术进行海洋生物资源开发和海洋食品、功效物质与材料的生物制造研究。主要有以下四个方面:(1)海洋食品酶学与生物催化;(2)海洋生物资源利用与水产品生物加工;(3)海洋功效物质的合成生物学与系统代谢工程;(4)生物材料制备与应用。研究室承担/参与国家自然科学基金委员会、科学技术部、农业农村部、以及省市级研究课题和企业横向合作项目50余项,发表学术论文200余篇,授权国家发明专利90余项,获得各类科技奖励10余项。
本文图片来源于文章原文及作者团队。
