近日由来自重庆大学附属第一医院的侯胜平、谭珺、刘焕发表了篇新药研发专利,在该专利中,研究人员通过对ChemBridge化合物库进行高通量筛选,获得了一种新型的RORγt反向激动剂,N-((1H-苯并[d]咪唑-2-基)甲基)-3-(吗啉磺酰基)苯甲酰胺(简称CQMU151),并首次展示出其在自身免疫调节中的应用价值。AbMole(奥默生物)是ChemBridge在中国的唯一官方指定合作伙伴。

Th17细胞是有效的组织炎症诱导细胞,参与了许多炎症和自身免疫性调节过程。其中针对Th17细胞的IL-17表达已被证明对人类免疫系统有良好的调节作用。
IL-17转录受Th17特异性转录调节因子RORγt调控,目前,地高辛和熊果酸等RORγt抑制剂特异性不好,易产生副作用。因此,研究人员想通过进一步的研究来寻找更加特异性的RORγt反向激动剂。
研究人员通过ChemBridge化合物库以RORγt为靶点,进行高通量筛选,筛选出化合物CQMU151(图一)。

图1.N-((1H-苯并[d]咪唑-2-基)甲基)-3-(吗啉磺酰基)苯甲酰胺(简称CQMU151)
随后,研究人员对CD4+T细胞进行的表面抗原CD4和IL-17A进行染色。通过流式细胞分析,研究人员发现,CQMU151能够剂量依赖性地抑制CD4+T细胞中IL-17A的表达,抑制其向Th17细胞分化(图2)。

图2.CQMU151体外抑制初始CD4+T细胞向Th17细胞分化结果
接下来,研究人员构建了RORγt过表达质粒和IL-17启动子的双荧光素酶报告基因质粒,并转染进入HEK-293T细胞进行报告基因实验。结果显示,CQMU151能够抑制RORγt介导的IL-17转录(图3)。

图3.CQMU51与靶点RORγt的结合测试结果
此外,研究人员在构建的自身免疫性葡萄膜炎(EAU)小鼠模型中给予CQMU151进行处理,并对EAU进展进行评分。结果显示,CQMU151能够明显改善EAU。(图4)
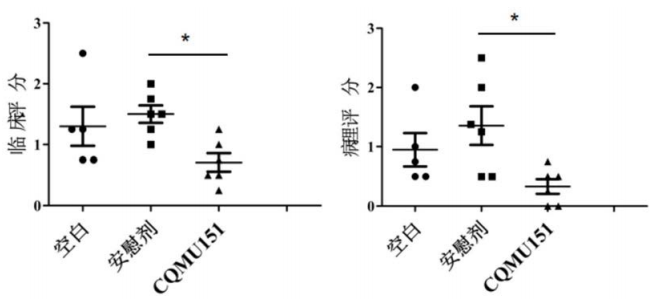
图4.CQMU51改善小鼠EAU
同时,为了验证在体内环境下CQMU151也能抑制CD4+T细胞向Th17细胞分化,研究人员取出小鼠的脾脏,消化为单个细胞,对CD4和IL-17进行染色并做流式分析。分析结果显示,CQMU151处理的小鼠脾脏中Th17细胞比例降低。(图5)

图5.CQMU51对Th17细胞分化的影响结果
除了EAU之外,Th17细胞也会影响自身免疫性脑脊髓炎(EAE)的进程。因此,研究人员在构建的EAE小鼠模型中给予CQMU151进行处理,并对EAE进展进行评分。结果显示,CQMU151也能够明显改善EAE(图6)。AbMole(奥默生物)是ChemBridge在中国的唯一官方指定合作伙伴。
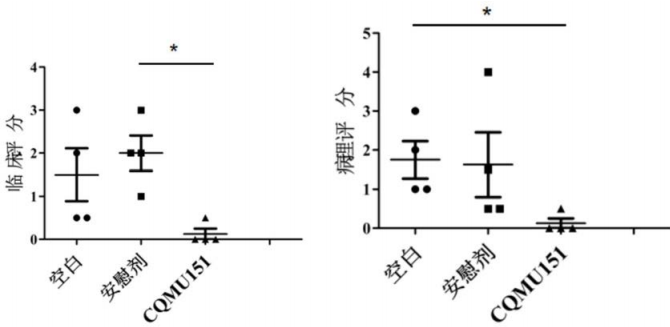
图6.CQMU51改善小鼠EAE
据报道,Ⅰ型糖尿病(T1DM)也是由自身免疫引起的。因此,研究人员在使用STZ构建的T1DM小鼠模型中给予CQMU151进行处理,并对模型小鼠的进食量、饮水量和T1DM发病率进行观察统计。结果显示,CQMU151也能够明显改善T1DM。(图7)

图7.CQMU51改善小鼠T1DM
综上所述,在本发明中,研究者首先通过ChemBridge化合物库筛选出优质的RORγt反向激动剂——CQMU151。在此基础上,研究者从CQMU151的抑制RORγt介导的IL-17表达、抑制体内外Th17细胞的分化以及调节改善自身免疫反应三个方面的左右进行的探索和评价。最终发现CQMU151能够显著抑制Th17细胞的分化,适用于自身免疫的调节。AbMole(奥默生物)是ChemBridge在中国的唯一官方指定合作伙伴。
鸣谢:重庆大学附属第一医院:CN 111658651 A
