
编者按
胆道癌(BTC)也被称作“沉默的杀手”,占成人癌症比例不到1%,预后不良,患者生存期有限。当前治疗以手术、化疗为主,但效果有限。近年来,各类靶向药物、免疫检查点抑制剂(ICI)为BTC患者增加了新的治疗选择。在刚刚落幕的2024年美国临床肿瘤学会(ASCO)年会上报道了多项BTC的新药研究进展,现整理三项口头报告研究如下。
一项阿替利珠单抗和Varlilumab(CDX-1127)加或不加Cobimetinib用于经治无法切除胆管癌的II期随机研究[1]背景
在接受了一线化疗的晚期BTC患者中,联合使用MEK抑制剂(MEKi)和PD-L1阻断剂与单独使用PD-L1阻断剂相比,显著延长了无进展生存期(PFS)(NCT03201458)。进一步的研究表明,MEKi能够增强肿瘤免疫原性,但会损害宿主T细胞的激活/启动。在MEKi系统治疗的基础上加入免疫激动剂,如CD27激动剂,可以在体内激活T细胞功能,并可能作为MEKi与检查点阻断联合使用时优化其免疫调节潜力的有效策略。
方法
这项随机II期临床试验(NCT04941287)在无法切除且既往接受过治疗的BTC患者中评估了阿替利珠单抗与CD27免疫激动剂[CDX-1127(Varlilumab)]联合使用,加或不加MEKi(Cobimetinib)的效果。纳入的受试者包括经病理学证实的成人BTC患者,这些患者至少接受过一种(但不超过两种)系统治疗,具有可测量的疾病,且ECOG体能状态评分(PS)≤1。既往接受过PD-(L)1抑制剂治疗的患者也被纳入。该研究计划招募64名可评估受试者,按1:1的比例随机分配,根据BTC部位进行分层,接受AV[阿替利珠单抗(840 mg,第1、15天静脉注射)+Varlilumab(3 mg/kg,第1、15天静脉注射)]或CAV[Cobimetinib(60 mg,第1-21天口服,第22-28天停药)+阿替利珠单抗+Varlilumab]治疗。主要终点包括客观缓解率(ORR)和PFS。主要相关结局是CD8+浸润性T细胞与治疗相关的变化。

结果
基于ORR的预设中期分析显示,两个治疗组均未达到继续进行的阈值,因此该试验因无效而提前终止。共纳入57名患者[n=29(CAV),n=28(AV)],其中67%为肝内胆管癌,33%之前接受过PD-(L)1抑制剂治疗。CAV和AV方案均具有良好的耐受性,未出现新的安全信号。添加CDX-1127似乎并未在已知的PD-L1毒性特征之外显著增加免疫毒性。ORR为0%(CAV)和3.8%(AV)。中位随访时间为6.2个月时,中位PFS为2.40(CAV)和1.84(AV)个月(HR 0.67,P=0.169)。在PD-(L)1抑制剂经治患者中,中位PFS为3.62(CAV)和1.84(AV)个月(HR 0.54,P=0.269)。中位总生存期(OS)为7.96(CAV)和6.08(AV)个月(HR 0.96,P=0.908)。在PD-(L)1抑制剂经治患者中,CAV和AV的中位OS分别为6.36(CAV)和4.44(AV)个月(HR 0.56,P=0.378)。

结论
阿替利珠单抗和Varlilumab联合或不联合Cobimetinib在晚期BTC患者的后线治疗中安全但并未改善临床结局。尽管在统计学上无显著意义,但在免疫治疗经治患者中,CAV治疗在数值上显示出比AV更有利的PFS/OS。
Sitravatinib联合替雷利珠单抗治疗既往至少接受过1种全身治疗失败的晚期胆管癌患者的II期研究[2]背景
在晚期BTC的一线治疗中,ICI与细胞毒性化疗联合用药已成为标准治疗方案,这一结论得到了TOPAZ-1和KN-966研究的支持。在这一背景下,二线或更后线治疗中开发ICI新药是迫切且未满足的医疗需求领域。抗血管生成药物通过增加肿瘤抗原的呈递以及促进淋巴细胞的浸润和迁移来诱导改善抗肿瘤免疫应答。
方法
本研究是一项开放性、II期临床试验,旨在研究小分子酪氨酸激酶抑制剂Sitravatinib和替雷利珠单抗(Tislelizumab,一种PD1抑制剂)联合给药二线治疗晚期BTC的疗效。曾接受过ICI治疗的患者可纳入研究。所有患者每天口服Sitravatinib 120 mg,并结合每3周静脉注射一次替雷利珠单抗200 mg,直至疾病进展或出现不可接受的毒性。主要终点是疾病控制率(DCR),关键次要终点包括ORR、PFS、OS和安全性。总共进行了三次组织活检:筛选、首次反应评估和疾病进展。每周期采集血样。

结果
共有43名患者入组。数据截止日期为2023年7月31日。中位随访时间为10.5个月(95%CI:7.03-15.6)。9名患者之前接受过ICI治疗。本研究达到了主要终点,即所有患者的DCR为65.1%。ITT人群的ORR分别为20.5%;PFS为4.93个月(95%CI:3.10-8.87);OS为10.3个月(95%CI:6.67-18.2)。无论之前是否接受过ICI治疗,均观察到类似的疗效。
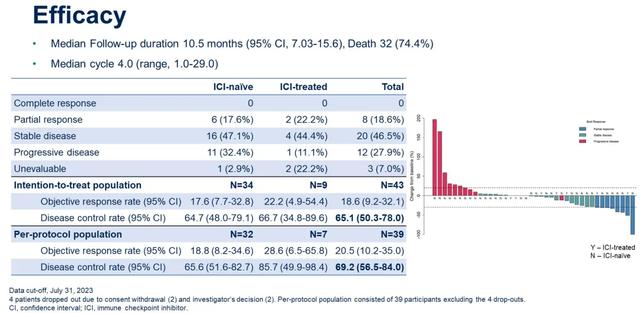

最常见的治疗相关的不良反应(AEs)与Sitravatinib相关,包括手足综合征(任何级别60.5%,3/4级0%),高血压(任何级别34.9%,3/4级11.6%)。免疫相关不良反应(irAEs)的发生率为46.5%,其中大多数irAEs为1-2级。

探索性分析发现,在基线活检组织中经下一代测序(NGS)检测到同源重组缺陷(HRD)(频率为18.5%)的患者比未检测到HRD的患者具有更高的ORR(60% vs. 13.6%),更长的PFS(未达到 vs. 4.87个月)和OS(21.1 vs. 8.57个月)。通过循环肿瘤DNA(ctDNA)检测到的HRD在患者选择中起到了补充作用。RNA测序显示在筛选和治疗过程中的肿瘤组织中,炎症信号上调,而血管生成信号下调。与无应答者相比,应答者在基线和治疗过程中的肿瘤组织中显示出更高的炎症信号。


结论
在晚期BTC患者中,Sitravatinib联合替雷利珠单抗组合作为二线疗法显示出有意义的疗效和可接受的安全性。特别是使用HRD生物标志物进行患者选择可能是该治疗背景下的一个有希望的策略。
在全身治疗基础上加入立体定向放疗用于局晚期胆管癌:来自一项随机II期试验的结果[3]背景
对于不可手术、非转移性胆管癌(CC)的局部区域治疗尚未明确。单臂II期数据表明,立体定向体部放疗(SBRT)可能改善临床结局。本研究旨在探讨在局部晚期不可手术的胆管癌中,将SBRT与吉西他滨联合顺铂(CisGem)治疗相结合的有效性和安全性。
方法
ABC-07(ISRCTN:10639376)是一项针对组织学证实为不可手术的局部晚期胆管癌患者的II期多中心随机试验,患者的世界卫生组织(WHO)体能状态评分为0-1。在注册后,接受4个周期CisGem治疗且未出现疾病进展的患者,在完成6个周期后,按照2:1的比例随机分配进行后续治疗:一种是SBRT(根据肿瘤大小,分为5次给予50 Gy或15次给予67.5 Gy),另一种是再接受两个周期的CisGem治疗(仅CG)。主要终点是PFS。本研究计划随机分配65名患者,以80%的检验效力和15%的单侧α值,检测PFS中位数从10.4个月增加到17.4个月。次要终点包括OS、毒性和失败模式。进行了放疗质量保证。

结果
在2016年3月至2022年8月期间,英国16个中心随机分配了69名患者(SBRT组45人;仅CG组24人)。中位年龄为66岁(范围38至83岁),58人(84.1%)为肝门部位置,48人(69.6%)有支架在位,中位肿瘤大小为3.5 cm(范围0.6-10.5 cm)。中位随访时间为20.7个月。在SBRT组中,43人(96%)完成了6个周期的CisGem治疗,41人(91%)接受了SBRT治疗。在仅CG组中,18人(75%)完成了8个周期的治疗。
从随机分组开始,SBRT组和仅CG组的中位PFS分别为8.6个月和9.0个月(HR 1.00;95%CI:0.58-1.70;P=0.989)。SBRT组首次PFS事件中有7例(16%)为局部复发,24例(53%)为转移复发,而仅CG组分别为7例(29%)和7例(29%)。从注册开始,SBRT组的中位OS时间为23.4个月(95% CI:14.6,27.7),而仅CG组为17.2个月(95% CI:10.2,NR)。随机分组后,SBRT组的OS为19.4个月(11.2,24.6),而仅CG组为14.2个月(7.0,NR)(HR 0.79;95%CI:0.41-1.51;P=0.47)。


在SBRT组和仅CG组中,分别有33人(73%)和21人(88%)发生了≥3级的不良事件。在第6个周期前,SBRT组的胆道脓毒血症等感染病例有19例(42%),而仅CG组有7例(29%);第6个周期后,SBRT组有17例(38%)脓毒血症病例,而仅CG组有6例(25%)。SBRT组有1例3级十二指肠出血和1例因脓毒血症死亡。SBRT组和仅CG组的主要死因分别为疾病(20例,44% vs. 11例,46%)、败血症(5例,11%vs. 3例,13%)和肝衰竭(0 vs. 3例,13%)。


结论
SBRT在PFS方面并未显示出优于仅CG的优势,但观察到更长的中位OS时间和更好的原发肿瘤控制,且没有安全性问题。然而,仍需要更成熟的生存数据。
参考文献:
[1]Thatcher Ross Heumann,et al.A randomized phase 2 study of combination atezolizumab and varlilumab (CDX-1127) with or without addition of cobimetinib in previously treated unresectable biliary tract cancer.J Clin Oncol 42, 2024 (suppl 16; abstr 4017)
[2]Jeesun Yoon, et al. Phase II study of sitravatinib in combination with tislelizumab in patients with advanced biliary tract cancer who have failed to at least 1 prior systemic treatment.J Clin Oncol 42, 2024 (suppl 16; abstr 4018)
[3]Maria A. Hawkins, et al. Addition of stereotactic body radiotherapy (SBRT) to systemic chemotherapy in locally advanced cholangiocarcinoma (CC) (ABC-07): Results from a randomized phase II trial.J Clin Oncol 42, 2024 (suppl 16; abstr 4006)
