泛素通过调节蛋白质稳定性在细胞过程中发挥着至关重要的作用,但旨在抑制癌症生长的USP28抑制剂也会影响USP25,导致显著的副作用。维尔茨堡大学的研究人员发现了为什么USP28和USP25抑制剂是非特异性的,目前正在开发更精确的抑制剂。

泛素相关酶USP28和USP25在细胞过程中起着关键作用,但它们相似的结构导致了目前使用抑制剂治疗癌症的挑战。维尔茨堡大学的研究旨在完善这些抑制剂,使其更具针对性,减少副作用。
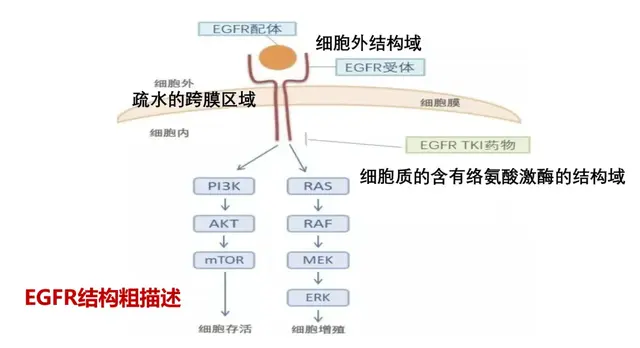
泛素是一种小蛋白质,通过调节大多数蛋白质的稳定性和功能,在几乎每一个细胞过程中都发挥着至关重要的作用。当泛素附着在其他蛋白质上时,它通常会标记它们的降解。然而,这个过程可以被特定的酶逆转。其中一种酶USP28有助于稳定对细胞生长和分裂至关重要的蛋白质,这也有助于癌症的发展。
为了降低这些蛋白质的稳定性,从而抑制癌症生长,已经开发了USP28抑制剂。这些抑制剂构成了目前正在开发的许多抗癌药物的基础,通过阻断USP28酶来破坏细胞分裂。问题是,它们通常不仅对USP28起作用,而且对USP25起作用,USP25是一种将泛素与其他蛋白质分离的密切相关的酶,被认为是免疫系统的关键蛋白质。因此,由于可预见的副作用,从胃肠道问题到神经损伤甚至自身免疫性疾病,将USP28抑制剂进一步开发成可在临床上使用的治疗方法非常困难。
两种酶混淆的风险维尔茨堡大学(JMU)的研究人员现在已经发现了为什么抑制剂不仅针对USP28,而且针对USP25:“显然,USP28和USP25之间存在很高的混淆风险”,维尔茨堡Rudolf Virchow中心结构生物学主席、研究和青年科学家副总裁Caroline Kisker解释道:“我们已经能够证明,这两种酶在许多方面非常相似,甚至完全相同,包括抑制剂的确切作用。”

USP28与抑制剂AZ1复合物的结构。突出显示与USP25相似(黄色)或相同(绿色)的所有氨基酸。特别是,抑制剂结合的区域(用红色箭头标记)在两种蛋白质中是相同的。来源:Kisker/JMU
作为研究的一部分,这位生物化学家的团队使用X射线晶体学分析了USP28与三种抑制剂“AZ1”、“Vismodegib”和“FT206”的结构,从而确定了空间结合位点。对USP25的进一步生物化学实验表明,抑制剂与USP28和USP25结合的位点是相同的。Kisker说:“因此,抑制剂无法区分它们在哪里结合。”“这解释了非特异性效应。”
这一发现为开发精确抑制剂铺平了道路新的科学发现为寻找副作用更少的特效药提供了重要基础。他们的发展是维尔茨堡研究人员的下一个主要目标。Kisker说:“我们的结构生物学数据使我们能够修改现有的抑制剂,使其仅对USP25或USP28有效。我们还想寻找与不太相似的酶位点结合的抑制剂。这将使这些分子具有更高的靶向精度。”
来源:维尔茨堡大学
免责声明:康嘉年華致力于健康常识分享,内容根据公开资料编辑,版权归原作者;如有侵权请在线留言删除。文章旨在介绍健康科学进展,不能作为治疗方案;如需精准健康指导,请至正规医院诊疗。