T细胞受体库测序(T cell receptor repertoiresequencing,TCR-Seq)是以生物信息学(Bioinformatics)全面高速分析高通量测序技术(High-throughputsequencing,HTS)检测靶向扩增后的T细胞抗原识别决定性表面分子,即T细胞受体(T cellreceptor,TCR)多样性的检测技术,用以揭示机体在生理和病理状态下T细胞介导的细胞免疫应答(T cell-mediated immuneresponse)状态改变。
T细胞介导的细胞免疫应答过程中,抗原呈递细胞(antigen-presenting cell,APC)摄取抗原(Ag)、消化形成抗原-MHC分子复合物,并呈递给T细胞。T细胞通过自身T细胞受体β链中V-D-J基因重排后的CDR3β参与抗原识别。

TCR的基因由可变区(V)、多变区(D)、结合区(J)和恒定区(C)四部分基因片段组成,形成互补决定区(complementarities determining region,CDR)和间隔的4个骨架区(frameworkregion,FR),基因结构如下图所示。在T细胞发育过程中CDR1、2和FR区域相对保守,CDR3区由V、D和J进行重排而形成具有功能的TCR编码基因(T细胞克隆),由于V(65~100种)、D(2种)、J(13种)基因片段本身具有多样性,此外,由于在重排的过程中,在VD及DJ的连接区经常有非模板的核苷酸的随机插入或删除,进一步增加了CDR3区的多样性。这种基因片段连接的不准确性使TCR的表达呈多样性,以识别各种不同的抗原。

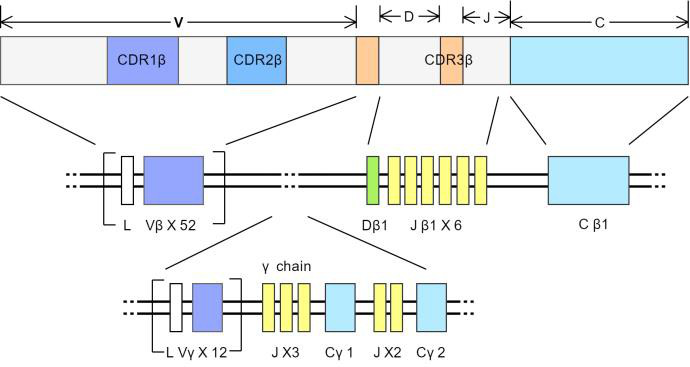
TCR基因结构,左:α链基因结构,右:β链基因结构
TCR-seq常用于评价各种免疫相关疾病和遗传性突变引起的某个物种所有T细胞或特定T细胞激活介导的细胞免疫反应中TCR基因重排碱基序列,以及各序列的丰度,用于研究不同T细胞克隆的转录情况和相互间关系,从而揭示更深层次的T细胞功能特异性,继而解释免疫应答机制、免疫耐受原因,免疫调节形式等相关生命现象。
TCR-seq的应用方向:(1) 肿瘤免疫治疗后的监测和治疗指导;
(2) 抗感染免疫治疗效果和耐受性评估;
(3) 移植排斥反应中急性排斥反应的预测和干预指导;
(4) 自身免疫疾病的临床试验和科学研究;
(5) 感染性和神经可塑性疾病的生物标志物。
技术参数样 品 准 备
测 序 策 略
推 荐 数 据
周 期
1μg RNA
2x105T淋巴细胞
HiSeq PE250测序
2.5 Gb clean data
5 Gb clean data
40个工作日
建库方法工作流程


康测科技技术优势
(1) 靶向检测TCR的RNA序列,与DNA分析相比,获得更为全面和准确的TCR多样性信息;
(2) 自主创新的UID技术帮助实现TCR表达量的绝对定量;
(3) 非多重PCR,可检测到更多的V-J pairing多样性;
(4)UID技术纠正PCR和测序错误,锁定真实序列,准确分析TCR的多样性;
(5) 提供从样本处理、TCR扩增、建库测序到数据分析的一站式完善服务;
(6) 根据用户的具体需求,提供个性化的数据分析内容。
部分结果展示
V-J 基因对使用频率分布图

CDR3 编码产物长度分布

CDR3 编码产物 motif 分析

组间多样性比较
案例解析TCR测序发现肿瘤组织中TCR多样性降低
通过TCR-seq获得α链和β链全长序列信息,发现大部分细胞的TCR中α链和β链都是唯一的(unique)。拥有一对完全一样的α链和β链可能来源于同一祖细胞,α-β链配对模式为3个以上细胞共有的情况,作者将其定义为扩增克隆(clonal)。
正常组织和外周血中发现的克隆TCR只占总CD8+T细胞的10%左右,而在肿瘤组织中,该比例高达约30%。与外周血或癌旁组织相比,肿瘤组织CD8+T细胞的TCR克隆要高得多,在调节T细胞中也发现了类似的富集现象,这可能是由于肿瘤病灶处的 T细胞被激活并增殖导致的。

肝癌肿瘤组织中,有两个甚至多个克隆 TCR 的 T 细胞比例升高
肿瘤微环境内的T细胞易于发生耗竭或调节T细胞发生抑制,在肝细胞癌(HCC)肿瘤微环境中的肿瘤浸润细胞,效应CD8+T细胞更少,而耗竭细胞更多。且越是晚期的患者,T细胞的耗竭趋势越明显。克隆的T细胞群(含有4个以上的克隆细胞)也更多的表现出耗竭趋势。
参考文献
ZhengC,ZhengL,YooJK,etal.LandscapeofInfiltratingTCellsinLiverCancerRevealedbySingle-CellSequencing.[J].Cell,2017,169(7):1342-1356.
