天然免疫是机体免疫防御的第一道防线,再维持机体的生理健康方面具有非常重要的作用,因此天然免疫一直是研究的热点。今天分享的文章发表在2019年4月29日Nature子刊Nature Immunology杂志上,研究的是lncRNA在天然抗病毒免疫反应中的功能,是浙江大学医学院曹雪涛院士课题组的成果。
研究背景和要解决的科学问题
RNA传感器RIG-I(retinoic acid-inducible gene I)在宿主防御反应中起着至关重要的作用,被激活的RIG-I能启动下游信号传导,产生I型干扰素(IFN),以消除侵入的RNA病毒。不同位点泛素化修饰的RIG-I调节着抗病毒免疫反应。尽管E3连接酶TRIM25(tripartitemotif25)在RIG-I介导的抗病毒药物中起关键作用,其调节抗病毒活性的机制并未得到深入了解。与此同时,长非编码RNA(lncRNA)在免疫细胞发育和免疫反应起重要作用,然而,在先天免疫应答的早期阶段,lncRNAs与关键信号分子相互作用以增强抗病毒先天免疫反应,这一机制还未被揭示。
本文主要描述了新发现的lncRNALncac3h7a与TRIM25和激活的RIG-I结合,并稳定了TRIM25-RIG-I相互作用。

科学问题拆解
(1)什么lncRNA能与TRIM25结合?
(2)此lncRNA对其功能和细胞/组织表型有什么样的影响?
(3)此lncRNA的调控机制是什么?
实验设计和结果
为了找到与TIM25结合的lncRNA,作者使用CLIP-seq(紫外交联免疫沉淀结合高通量测序)技术分别检测了未受感染和受RNA病毒VSV(vesicularstomatitisvirus)感染的巨噬细胞,发现TRIM25与Lnczc3h7能够相互结合。作者还分别使用pull-down技术、免疫共沉淀技术和免疫荧光技术进行验证,发现Lnczc3h7的确能够结合TRIM25。

Lnczc3h7结合TRIM25后,是否影响TRIM25-RIG信号通路介导的抗病毒免疫反应呢?作者在细胞中敲除了Lnczc3h7,随后发现VSV诱导INF-α、INF-β和IL-6产生明显减少,病毒复制明显增加。


用VSV感染小鼠之后,与正常小鼠相比,Lncac3h7a敲除小鼠血清中的INF-α、INF-β和IL-6产生明显减少,各器官中的Ifna等免疫蛋白基因表达量也显著降低,VSV的基因表达量显著升高,小鼠肺组织病变更加严重,小鼠的生存率也降低了。

那么,Lnczc3h7a促进抗病毒免疫反应的机制是什么呢?由于TRIM25诱导RIG发生K63位泛素化是RIG信号通路活化的关键信号,作者猜测Lnczc3h7a与TRIM25的结合能够促进RIG的K63位泛素化。通过过表达Lnczc3h7a和免疫共沉淀,RIG第63位泛素化的确增强了。
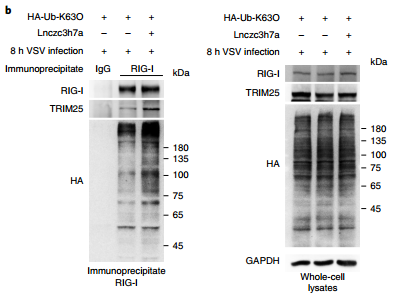
不仅如此,Lnczc3h7a还能促进RIG-TRIM25的相互作用。

作者进一步研究了Lnczc3h7a与蛋白的结合区域/位点。首先,通过pull-down实验,证实Lnczc3h7a结合了TRIM25的SPRY结构域,再通过iCLIP技术,找到TRIM25和RIG与Lnczc3h7a的结合位点。用双荧光素报告技术和邻位连接技术确认了结合位点。


总结
在本工作中,作者首先通过CLIP技术找到与TIM25结合的lncRNALnczc3h7a,进而通过细胞学和动物模型对其功能进行了研究,并揭示了Lnczc3h7a在TRIM25-RIG信号通路的分子机制。lncRNA作为miRNA海绵的ceRNA机制已经众所周知了,但在本文中,lncRNA主要作为分子骨架,起到了桥接不同蛋白并影响其功能的作用。所以,在研究lncRNA时,不要仅仅只从ceRNA机制方面着手,lncRNA还有很多宝藏供广大科研工作者挖掘。
