研究背景
生物-机器接口和生物医学工程技术的出现,如表皮电极、多模式生理信号监测、生物传感、神经元电记录和刺激、感觉运动功能修复、虚拟现实和增强现实等,均迫切需要一种具有高效触觉传感能力和生物相容性的堆叠传感平台,以检测人类皮肤的生理功能,并使工业机器人和假肢技术能够感知触觉信息。水凝胶,以其独特的类固体粘弹性、类液体渗透性和溶胀特性,以及模拟体内微环境的能力,成为触觉传感领域极具前景的基质替代品。然而,最先进的基于聚合物水凝胶的触觉传感器和电子皮肤技术存在不可逆的共价结合、难以调控的物理化学性质和有限的生物相容性,从而限制了其在生物-机器界面领域的广泛应用。肽超分子水凝胶,即由各向异性自组装纠缠的3D纳米纤维网络,在各种生物医学和生物机器界面应用中补充聚合物对应物,引起了越来越多的兴趣。其中,Fmoc-FF水凝胶凭借其超快的自组装动力学、细胞外基质状3D网络、模拟生物受限系统的粘性水纳米池以及出色的共组装特性,展现出作为开发触觉传感平台的生物启发超分子基质的潜力。然而,机械刚度较弱和自组装过程的调控难度较大,严重阻碍了Fmoc-FF水凝胶在触觉传感应用中的进一步发展。
研究成果
近日,浙江大学陶凯研究员、潘定一教授和修鹏副教授,通过引入聚乙二醇二丙烯酸酯(PEGDA)来调控9-芴甲氧羰基-改性二苯基丙氨酸(Fmoc-FF)的自组装,成功实现了从较薄的纳米纤维到更宽纳米带的转变,将超分子水凝胶的机械性能提高了10倍,为触觉传感提供了生物启发的超分子封装基底。此外,通过掺杂PEDOT:PSS和9-芴甲氧基羰基改性的3,4-二羟基-L-苯丙氨酸(Fmoc-DOPA),将Fmoc-FF自组装水凝胶设计成具有导电性和粘性的材料,为触觉传感应用提供仿生传感单元和粘合层。因此,这些模块的集成产生了基于肽水凝胶的触觉传感器,显示出高灵敏度和可持续的响应,同时具备出色的生物相容性和生物降解性。这一发现为触觉传感应用开发具有可调节特征的可编程肽自组装奠定了可行性。相关研究工作以“Bioinspired Flexible Hydrogelation with Programmable Properties for Tactile Sensing”为题发表在国际顶级期刊《Advanced Materials》上。

研究内容
通过引入PEGDA作为共溶剂,成功使Fmoc-FF自组装体系的结构从传统的较薄纳米纤维转变为纳米螺旋,然后再到纳米带,从而使水凝胶的杨氏模量提高10倍,这表明其是用于触觉传感的受生物启发的包封基底。接下来,通过Fmoc-FF与PEDOT:PSS和Fmoc-DOPA的共组装,将自组装的纳米纤维水凝胶进一步设计成导电和粘合的,从而为触觉传感器提供仿生传感单元和粘合层。因此,模块的集成可以产生基于Fmoc-FF水凝胶的触觉传感器,具有内在生物相容性和生物降解性,且表现出与最先进聚合物对应物相当的性能,如灵敏度和耐用性(方案1)。研究成果证明了基于肽的可编程超分子水凝胶用于触觉传感的可行性,从而为生物-机器界面和生物医学工程应用提供了生物启发的替代品。

方案1. 基于触觉传感器的仿生超分子水凝胶的发展示意图
1、Fmoc-FF自组装的形态调控
为了深入研究PEGDA700对Fmoc-FF水凝胶自组装的影响及其力学特性,进行了TEM表征。具体而言,当χPEGDA700为零时(原始Fmoc-FF水凝胶),观察到直径为12.7±1.9nm的薄且密集的纳米纤维(图1a(i))。随着χPEGDA700增加到5%(v.),纳米纤维的直径增加至17.2±3.7nm,且捆绑趋势减弱(图1a(ii))。当χPEGDA700增加到10%(v.)时,TEM图像主要显示广泛分布、不均匀、宽的纳米带,同时纳米纤维数量减少且直径为26.4±6.5nm(图1A(iii)),证实了薄纳米纤维逐渐转变为宽纳米带。事实上,当χPEGDA700设定为7.5%(v.)时,大量直径为40.2±8.9nm的左旋纳米螺旋结构(图1b)主导了TEM图像,这些纳米螺旋的尺寸大于纳米纤维,并展示了阶梯状纹理(图1b插图),从而揭示了Fmoc-FF自组装经历的分级过程,纳米螺旋是纳米纤维和纳米带之间的过渡阶段,这在以前的报告中鲜有实验验证。
当χPEGDA700进一步增加至15%(v.)时,宽度为245.4±70.7nm的均匀纳米带占据了主导地位(图1A(iv)),揭示了PEGDA700的强溶解能力能够完全消除Fmoc-FF自组装过程中的扭曲现象。随后,随着χPEGDA700增加到20%(v.),细长的自组装体不再存在,并且观察到宽度为27.5±7.0nm的聚集片段(图1A(v)),表明Fmoc-FF单体在高比例的PEGDA70下不能组织成更大的结构。可以得出结论,PEGDA700的引入,使Fmoc-FF自组装经历了从薄纳米纤维到宽纳米带的转变,其中纳米螺旋作为中间体(图1C)。

图1. 依赖Fmoc-FF自组装的PEGDA700
2、Fmoc-FF水凝胶的机械增强
结构演变会影响生物启发的超分子水凝胶的力学特性。具体而言,在增加χPEGDA700时,系统的储能模量(G')呈现抛物线演变趋势。与原始Fmoc-FF水凝胶的40.5±10.9kPa相比,当χPEGDA700达到15%(v.)时,G'显著提升至438.1±53.6kPa(图2a),从而证明较宽纳米带的交联比较薄纳米纤维的交联更有效。然而,随着χPEGDA700的进一步增加,由于自组装体的碎片化,G'又出现了明显的下降(图2a)。
为了阐明结构解扭曲诱导的机械性能增强的机制,创建了纳米纤维和纳米带的数值模型,并通过介观耗散粒子动力学方法进行了流体动力学模拟(图2b)。模拟结果表明,当施加振荡剪切时,与基于纳米纤维的水凝胶相比,基于纳米带的水凝胶显示出更大的复杂响应函数实部(图2c),对应于实验中更高的G'。在这两个系统的应变-应力曲线(利萨如曲线)中也观察到了类似的结果(图2d),基于纳米带的水凝胶在相位差上表现得更为显著。模拟和实验的协同作用表明,Fmoc-FF自组装刚性、基于纳米带和柔软的纳米纤维水凝胶可以分别用作封装基底和传感单元,以开发适用于可穿戴和植入式应用的仿生触觉传感器。
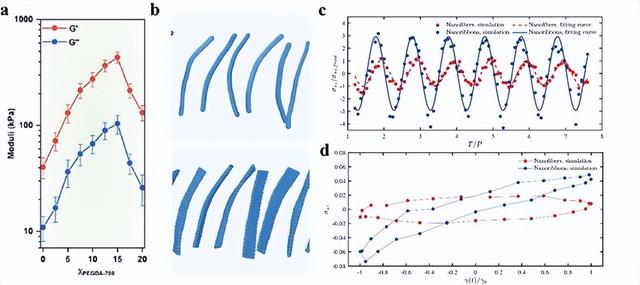
图2. Fmoc-FF水凝胶的PEGDA700相关机械性能
3、基于Fmoc-FF水凝胶的触觉传感器
为了促进仿生水凝胶的触觉传感应用,引入了聚(3,4-亚乙基二氧噻吩):聚(苯乙烯磺酸盐)(PEDOT:PSS)与Fmoc-FF共组装,以开发压阻传感单元。具体而言,当PEDOT:PSS的质量分数(ω)增加到0.2%(wt.)时,系统G'从原始的42.8±4.6kPa略微降低至33.3±3.3kPa(图3a蓝线),其中二肽单体自组装成离散的、碎片化的纳米纤维,而非之前研究的成束、较长的纳米纤维(图3b上)。同时,系统的电导率从最初的8.9±2.8μS·cm-1提高到396.4±26.5μS·cm-1(图3a红线)。然而,当ωPEDOT:PSS进一步增加到0.4%(wt.)时,纳米棒成为主导形态(图3b下),导致超分子水凝胶的弹性急剧下降,G'仅为12.9±2.1kPa(图3a蓝线),系统失去自保持能力。因此,考虑到机械性能和导电性能之间的权衡,选择含有ωPEDOT:PSS=0.2%(wt.)的Fmoc-FF共组装纳米纤维水凝胶来开发用于触觉传感的传感单元。
为了开发一种实用的高灵敏度触觉传感器,设计了一个空间分辨率为6mm、厚度为3mm的3×3网格传感阵列,以高效地检测负载压力。随后,将具有最高储能模量值的χPEGDA700=15%(v.)的Fmoc-FF自组装纳米带基水凝胶模作为包封层。采用ωPEDOT:PSS=0.2%(wt.)的纳米纤维水凝胶作为敏感复合材料,由两个柔性印刷电路包围,形成压阻传感单元(图3c)。由于弹性低于封装层,一旦受到静态载荷,传感单元产生的应变比周围基板更高,这在传感器阵列的纵向截面应变分布中得到了证实(图3c插图)。
基于Fmoc-FF水凝胶的触觉传感器的∆R/R0演化曲线,在压力低于和高于8.0kPa时分别表现出S1=5.7%kPa-1和S2=0.5%kPa-1的两个分段斜率(图3d),检测极限范围为0.4kPa-15.0kPa,表明其灵敏度优于先前报道的由聚合物水凝胶组成的触觉传感器,如藻酸盐(SA)/二氧化硅纳米纤维(4.1%kPa-1)、聚乙烯醇(PVA)/SA(3.3%kPa-1)和PVA/聚丙烯酰胺(PAAm)(~5.0%kPa-1),从而展示了其在触觉传感领域中的巨大潜力。

图3. 基于Fmoc-FF水凝胶的触觉传感器的开发和表征
4、用于触觉传感应用的可编程Fmoc-FF水凝胶
肽的生物启发性质赋予了它们在生物医学和生物机器接口应用中的可行性。本工作首次研究了Fmoc-FF水凝胶的生物相容性和生物可降解性。具体而言,通过在小鼠体内皮下植入,评估了Fmoc-FF自组装纳米带基水凝胶在χPEGDA700=15%(v.)和掺杂Fmoc-FFF纳米纤维水凝胶在ωPEDOT:PSS=0.2%(wt)下的体内生物相容性。通过与广泛使用的明胶交联水凝胶对照,观察到在植入7天后,基于Fmoc-FF的水凝胶仅引起轻微的免疫反应,表现为松散的纤维化包封、低胶原密度,且未见巨噬细胞或异物巨细胞浸润(图4a上)。淋巴细胞数量的统计(200μm×200μm视野内)表明,基于Fmoc-FF纳米带的水凝胶的免疫反应性与基于明胶的水凝胶相当(图4b)。
在引入PEDOT:PSS后,混合水凝胶的生物相容性随着淋巴细胞数量的增加而略有恶化(图4a,b),这可能是由于导电聚合物的生物相容性限制。值得注意的是,植入7天后,Fmoc-FF基水凝胶几乎完全消失(图4a),可能被酶降解为氨基酸,这一点通过荧光标记检测得到了证实。作为对照,即使在3个月后,明胶基水凝胶仍存在于植入区域。这些发现表明,Fmoc-FF水凝胶具有优异的生物相容性和快速的生物降解性,从而证明了基于肽水凝胶的触觉传感器在生物医学和生物机器界面应用中的可行性。除了其与皮肤成分的内在同源性外,基于Fmoc-FF水凝胶的触觉传感器可以用作机器人假肢的仿生电子皮肤。
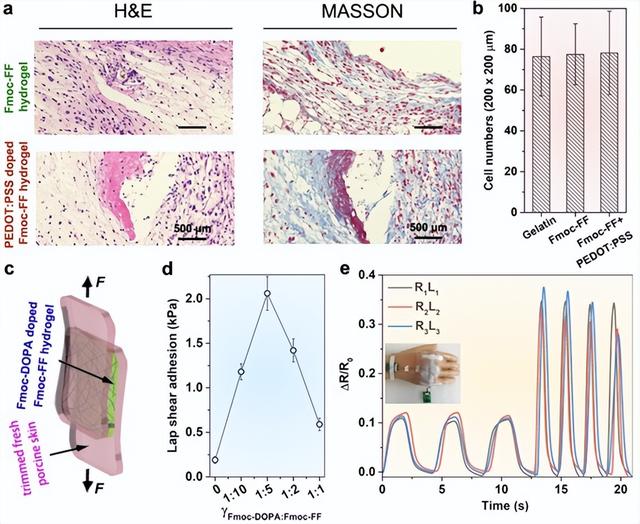
图4. 基于Fmoc-FF水凝胶的E-皮肤的开发和应用
结论与展望
尽管聚合物基底在触觉传感领域应用广泛,但其有限的生物降解性和生物相容性严重制约了其在生物-机器界面和生物医学工程领域的进一步应用。相比之下,短肽自组装水凝胶凭借其出色的生物相容性和生物降解性,以及高灵敏度,展现出作为触觉传感器超分子基质的巨大潜力。结合实验与计算特征,研究者证实Fmoc-FF水凝胶可以灵活编程,以满足触觉传感应用的要求。具体而言,通过引入PEGDA700,有效调控了Fmoc-FF自组装的形态,从薄纳米纤维转变为螺旋结构(χPEGDA700=7.5%(v.)),然后进一步演变为宽纳米带(χPEGDA700=15%(v.))。这显著提升了生物启发水凝胶的机械性能,使其成为先进的聚合物基底的理想替代品,可用于开发触觉传感器的封装层。此外,通过共组装策略,将Fmoc-FF水凝胶与PEDOT:PSS和Fmoc-DOPA进行掺杂,使Fmoc-FF水凝胶具有导电性和粘附性。尤其,通过优化掺杂比例(ωPEDOT:PSS=0.2%(wt.)和γFmoc-DOPA:Fmoc-FF=1:5),可以最大限度提高导电性和粘附性,为使用超分子水凝胶设计传感单元和粘附层提供了切实可行的方案。因此,结合这些组件,开发出了一种基于Fmoc-FF水凝胶的仿生触觉传感器,实现对具有固有生物相容性和生物降解性的假体运动的实时监测。
尽管自组装短肽在触觉传感领域尚处于起步阶段,但它具有高度的工程性和可编程性。通过调整氨基酸序列、自组装条件(不同溶剂或气相沉积)和组织方法(共组装、共价结合等),可以精确调控生物启发水凝胶的结构和性质,从而为开发用于生物机接口和生物医学应用的合适触觉传感平台提供了更多的可能性。肽自组装显示出对假肢设备、机器人、可穿戴和植入式设备等提供仿生控制的潜力,为用户带来更自然、高效的交互体验,有望为实现具有灵活调节和触觉传感能力以及生物相容性的集成检测平台铺平道路。
文献链接:
https://doi.org/10.1002/adma.202401678
